题目内容
【题目】已知ClO2常温下呈气态,其分子构型与水分子相似,在自然环境中ClO2最终变为Cl﹣ . 下列说法正确的是( )
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,对人体无任何危害
D.常用Na2SO3在H2SO4存在条件下,还原NaClO3来制ClO2 , 化学方程式为:Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O
【答案】D
【解析】解:A.水分子中价层电子对为 ![]() =4,孤电子对数为
=4,孤电子对数为 ![]() =2,为V形,分子构型与水分子的分子构型相似,ClO2的分子结构呈V型,正负电荷的重心不重合,电荷分布不均匀,属极性分子,故A错误;
=2,为V形,分子构型与水分子的分子构型相似,ClO2的分子结构呈V型,正负电荷的重心不重合,电荷分布不均匀,属极性分子,故A错误;
B.作为消毒剂,具有强氧化性,最终可生成Cl﹣ , 1molClO2可得5mol电子,而1mol氯气得到2mol电子,其消毒效率(以单位体积得电子的数目)是氯气的2.5倍,故B错误;
C.氯气在饮用水中有机物发生氯代,生成对人体有害的含氯有机物,不能广泛应用,应寻找替代品,故C错误;
D.Na2SO3和NaClO3在酸性条件下发生氧化还原反应生成ClO2 , 方程式为Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O,故D正确.
故选D.

【题目】根据所学知识填空。
(1)用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.Fe还原水体中NO3﹣的反应原理如图所示. 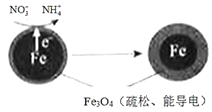
①作负极的物质是 .
②正极的电极反应式是 .
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)△H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如表:
化学键 | H﹣H | C﹣O | C﹣O | H﹣O | C﹣H |
E/(KJmol﹣1) | 436 | 343 | 1075 | 465 | 413 |
由此计算△H1=kJmol﹣1 . 已知△H2=﹣58kJmol﹣1 , 则△H3=kJmol﹣1 .