题目内容
下图表示在密闭容器中反应:2SO2(g)+O2(g) 2SO3(g),△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c-d处。
2SO3(g),△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c-d处。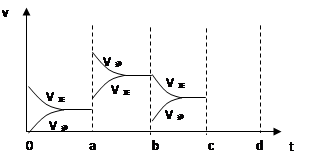
 2SO3(g),△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c-d处。
2SO3(g),△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c-d处。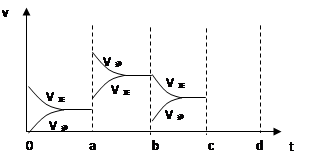
升温;取走部分SO3;
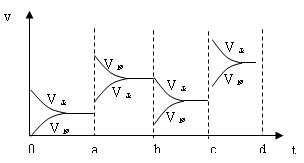

试题分析:根据反应的方程式可知,该反应是体积减小的放热的可逆反应。a点正逆反应速率均增大,但平衡向逆反应方向移动,所以改变的条件是升高温度;b点正反应速率不变,逆反应速率减小,平衡向正反应方向移动,所以改变的条件是取走部分SO3;若增大压强时,正逆反应速率均增大,平衡向正反应方向移动,则图像应该是
 。
。点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练。该题的关键是理解并能灵活运用勒夏特列原理,然后再结合图像和具体的反应式灵活运用即可,有利于培养学生的逻辑推理能力。

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
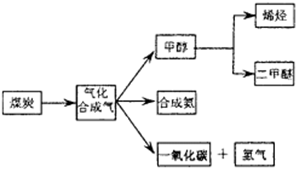
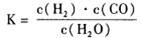
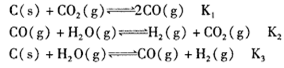
 , 该反应平衡常数随温度的变化如下:
, 该反应平衡常数随温度的变化如下:
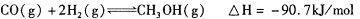
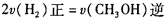
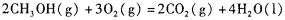 ,则负极的电极反应式为_______。
,则负极的电极反应式为_______。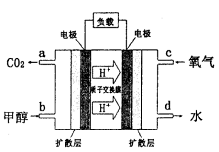
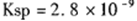 。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与
。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与 的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。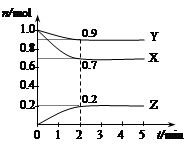
 2Z(g)
2Z(g)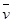 (X)=0.075 mol ·L-1· min-1
(X)=0.075 mol ·L-1· min-1 CO(g)+H2(g)在一可变容积的密闭容器中进行,达到平衡,下列条件能使平衡移动的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,达到平衡,下列条件能使平衡移动的是( ) 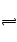 CO(g)+H2O(g)
CO(g)+H2O(g) C(g)+D(g)已达平衡的是
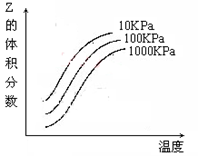
C(g)+D(g)已达平衡的是 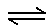 2Z 反应影响的示意图图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )。
2Z 反应影响的示意图图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )。