题目内容
【题目】能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的措施是( )
A. 将水加热煮沸,测得pH=6 B. 向水中加入FeCl3固体
C. 向纯水中投入一小块金属钠 D. 向水中加入Na2CO3固体
【答案】B
【解析】
水能发生微弱的电离:H2O![]() H++OH-,电离过程吸热。
H++OH-,电离过程吸热。
A.将水加热煮沸时,水的电离平衡向电离方向移动,H+浓度增大,pH可能为6,但水中仍有:c(H+)=c(OH-)。A项错误;
B.FeCl3加入水中发生水解反应:Fe3++3H2O![]() Fe(OH)3+3H+,促进水的电离平衡向右移动,溶液中c(H+)>c(OH-),B项正确;
Fe(OH)3+3H+,促进水的电离平衡向右移动,溶液中c(H+)>c(OH-),B项正确;
C.钠跟水反应置换氢,2Na+2H2O=2NaOH+H2↑,先促进水的电离平衡向右移动,后来NaOH又使水的电离平衡向左移动,但溶液中c(OH-)>c(H+),C项错误;
D.Na2CO3发生水解反应:CO32-+H2O![]() HCO3-+OH-,促进水的电离平衡向右移动,但溶液中c(OH-)>c(H+),D项错误;答案选B。
HCO3-+OH-,促进水的电离平衡向右移动,但溶液中c(OH-)>c(H+),D项错误;答案选B。

【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
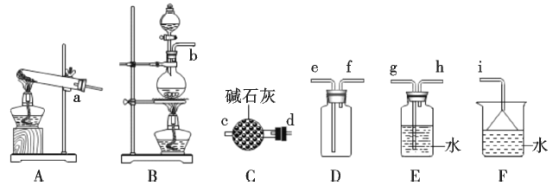
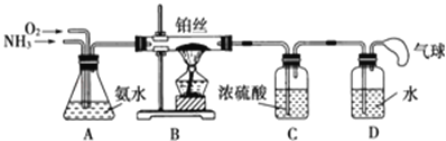
(1)氨气的制备
①氨气的发生装置中反应的化学方程式为__。装置C的仪器名称__。
②欲收集一瓶干燥的氨气,选择上图中的装置,其接口连接顺序为a→__(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
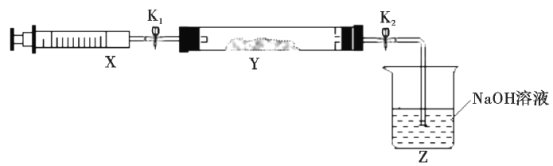
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中__ | ②反应的化学方程式___ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③__ | ④___ |