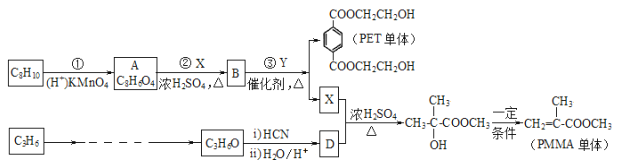
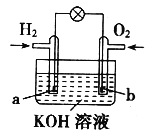
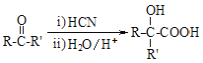题目内容
【题目】叠氮酸钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体。已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |
(1)制备NaN3:
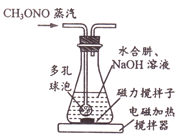
30℃时,水合肼(N2H4H2O)与亚硝酸甲酯(CH3ONO)、NaOH反应,装置如右图所示。反应后锥形瓶中混合物经“操作X”可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。
①装置中的多孔球泡的作用是______。
②写出生成NaN3的化学方程式:_________________。
③“操作X”的名称为________________。
(2)测定NaN3产品纯度: ①称取NaN3产品5.0000g,用适量稀硫酸溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入20.00mL0.2000mol/LKMnO4溶液,得紫红色溶液B;
③向溶液B加入足量KI溶液消耗过量的KMnO4溶液,然后以淀粉作指示剂,用0.1000mol/LNa2S2O3标准溶液滴定产生的I2,消耗Na2S2O3溶液30.00mL。测定过程中物质的转化关系如下:
10NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑
I- ![]() I2
I2 ![]() S4O62-
S4O62-
计算NaN3产品的纯度(写出计算过程)。_____________________
【答案】 增大CH3ONO与反应液的接触面积,加快反应速率 N2H4·H2O+CH3ONO+NaOH![]() NaN3+CH3OH+3H2O 蒸馏 I2+2S2O32-===2I-+S4O62- , n(I2)=
NaN3+CH3OH+3H2O 蒸馏 I2+2S2O32-===2I-+S4O62- , n(I2)=![]() =
=![]() =1.500 0×10-3 mol,过量的n(MnO4-)=
=1.500 0×10-3 mol,过量的n(MnO4-)=![]() n(I2)=6.000×10-4 mol,与NaN3反应的n(MnO4-)=0.200 0 mol·L-1×20.00×10-3 L-6.000×10-4 mol=3.400 0×10-3 mol,n(NaN3)=5n(MnO4-)=1.700 0×10-2 mol,w(NaN3)=
n(I2)=6.000×10-4 mol,与NaN3反应的n(MnO4-)=0.200 0 mol·L-1×20.00×10-3 L-6.000×10-4 mol=3.400 0×10-3 mol,n(NaN3)=5n(MnO4-)=1.700 0×10-2 mol,w(NaN3)=![]() ×100% =88.40%
×100% =88.40%
【解析】(1)①装置中用到多孔球泡,多孔球泡能增大CH3ONO与反应液的接触面积,加快反应速率(或使CH3ONO充分反应) ②N2H4·H2O与CH3ONO、NaOH反应生成NaN3 、CH3OH和H2O,反应的化学方程式为:N2H4·H2O+CH3ONO+NaOH![]() NaN3+CH3OH+3H2O
NaN3+CH3OH+3H2O
③可用蒸馏的方法从反应后锥形瓶中混合物回收CH3OH,因此“操作X”的名称为蒸馏。答案为:①增大CH3ONO与反应液的接触面积,加快反应速率(或使CH3ONO充分反应) ②N2H4·H2O+CH3ONO+NaOH![]() NaN3+CH3OH+3H2O③蒸馏
NaN3+CH3OH+3H2O③蒸馏
(2)由已知条件可知I2+2S2O32-===2I-+S4O62-,n(I2)=![]() =
=![]() =1.500 0×10-3 mol,过量的n(MnO4-)=
=1.500 0×10-3 mol,过量的n(MnO4-)=![]() n(I2)=6.000×10-4 mol,与NaN3反应的n(MnO4-)=0.200 0 mol·L-1×20.00×10-3 L-6.000×10-4 mol=3.400 0×10-3 mol,n(NaN3)=5n(MnO)=1.700 0×10-2 mol,w(NaN3)=
n(I2)=6.000×10-4 mol,与NaN3反应的n(MnO4-)=0.200 0 mol·L-1×20.00×10-3 L-6.000×10-4 mol=3.400 0×10-3 mol,n(NaN3)=5n(MnO)=1.700 0×10-2 mol,w(NaN3)=![]() ×100% =88.40%,答案为:I2+2S
×100% =88.40%,答案为:I2+2S![]() =
=![]() =1.500 0×10-3 mol,过量的n(MnO4-)=
=1.500 0×10-3 mol,过量的n(MnO4-)=![]() n(I2)=6.000×10-4 mol,与NaN3反应的n(MnO4-)=0.200 0 mol·L-1×20.00×10-3 L-6.000×10-4 mol=3.400 0×10-3 mol,n(NaN3)=5n(MnO4-)=1.700 0×10-2 mol,w(NaN3)=
n(I2)=6.000×10-4 mol,与NaN3反应的n(MnO4-)=0.200 0 mol·L-1×20.00×10-3 L-6.000×10-4 mol=3.400 0×10-3 mol,n(NaN3)=5n(MnO4-)=1.700 0×10-2 mol,w(NaN3)=![]() ×100% =88.40%
×100% =88.40%

 阅读快车系列答案
阅读快车系列答案【题目】【题目】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,相关信息如下:
元素 | 相关信息 |
X | 其单质为固体,常作电极材料 |
Y | 原子核外有6种不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(答题时,X、Y、Z、W、R、M用所对应的元素符号表示):
(1)X的单质与Z的单质反应的产物为_____________。(填化学式)。
(2)Z、W相比,第一电离能较大的是_____________,M2+的核外电子排布式为_____________。
(3)M2Z的熔点比M2W的_____________(填“高”或“低”),请解释原因______________________。
(4)Y和Z形成的化合物YZ2的VSEPR模型为__________,其中Y原子的杂化轨道类型为____________;N3-和YZ2互为等电子体,则N3-的结构式为_____________。
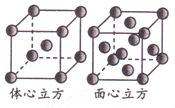
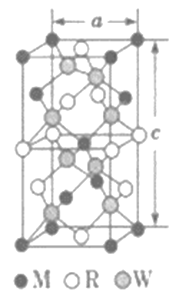
(5)MRW2的晶胞如图所示,晶胞参数a=0.524nm,c=1.032nm;MRW2的晶胞中每个M原子与_________个W原子相连,晶体密度ρ=________g·cm-3(只要求列算式,不必计算出数值,NA=6.02×1023mol-1)。
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
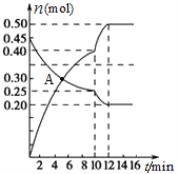
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温