题目内容
【题目】某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金),为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误: ( )
A.硫酸铜溶液
B.盐酸
C.稀硝酸
D.硝酸银溶液
【答案】C
【解析】解:铜和锌能和硝酸反应,而金不和稀硝酸反应,故C符合题意。
所以答案是:C

【题目】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,相关信息如下:
元素 | 相关信息 |
X | 其单质为固体,常作电极材料 |
Y | 原子核外有6种不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(答题时,X、Y、Z、W、R、M用所对应的元素符号表示):
(1)X的单质与Z的单质反应的产物为_____________。(填化学式)。
(2)Z、W相比,第一电离能较大的是_____________,M2+的核外电子排布式为_____________。
(3)M2Z的熔点比M2W的_____________(填“高”或“低”),请解释原因______________________。
(4)Y和Z形成的化合物YZ2的VSEPR模型为__________,其中Y原子的杂化轨道类型为____________;N3-和YZ2互为等电子体,则N3-的结构式为_____________。
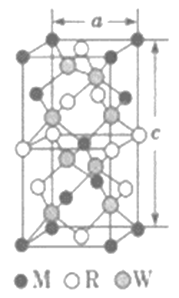
(5)MRW2的晶胞如图所示,晶胞参数a=0.524nm,c=1.032nm;MRW2的晶胞中每个M原子与_________个W原子相连,晶体密度ρ=________g·cm-3(只要求列算式,不必计算出数值,NA=6.02×1023mol-1)。
【答案】 Li2O O [Ar]3d9或1s22s22p63s23p63d9 高 O2-半径比S2-半径小,Cu2O比Cu2S的晶格能大,所以Cu2O的熔点高 直线形 sp杂化 [N=N=N]- 4 ![]()
【解析】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大。Y的原子核外有6个不同运动状态的电子,Y为C元素;X的单质为固体,常用作电极材料,X只能为Li元素;Z 是非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同,Z的电子排布式为1s22s22p4,为O元素;W是主族元素,与Zspan>原子的价电子数相同 ,W为S元素;R 的价层电子排布式为3d64s2,R为Fe元素;M位于第IB族,其被称作“电器工业的主角”,为Cu元素。
(1)锂与氧气反应生成氧化锂,故答案为:Li2O;
(2)同一主族,从上到下,第一电离能逐渐减小,O和S元素相比,第一电离能较大的是O,Cu2+的核外电子排布式为[Ar]3d9,故答案为:O;[Ar]3d9;
(3)氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高,故答案为:高;氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高;
(4)CO2中的C采用sp杂化,VSEPR 模型为直线型;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-,故答案为:直线型; sp;[N=N=N]-;
(5)由面心上Cu与2个S相连,晶胞中每个Cu原子与4个S相连;8个S均在体内,由化学式为CuFeS2,则含晶胞质量为![]() ,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=
,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=![]() =
=![]() =
=![]() gcm-3,故答案为:4;
gcm-3,故答案为:4;![]() 。
。
点睛:本题考查晶胞计算及杂化等,为高考常见题型和高频考点,侧重于学生的分析能力的考查,把握物质结构与性质、晶胞结构及计算等为解答该题的关键。本题的难点是晶胞的计算。
【题型】推断题
【结束】
12
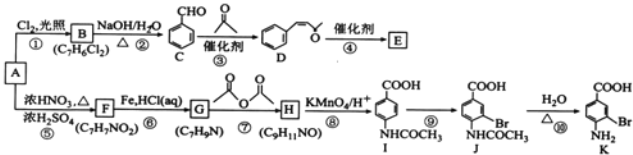
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如图所示:
已知: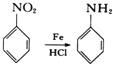 ;有机物分子中,同一个碳原子上连接有两个羟基时不稳定,会自动脱水。
;有机物分子中,同一个碳原子上连接有两个羟基时不稳定,会自动脱水。
回答下列问题:
(1)A的名称是_____________。K含有官能团的名称是__________________。
(2)反应⑦的作用是____________________________,⑩的反应类型是____________________________。
(3)写出反应②的化学方程式:____________________________________________________________。
(4)D分子中最多有_____________个原子共平面。E的结构简式为_____________。
(5)1molD与1molH2的加成产物同时满足下列条件的同分异构体有_____________种。
①苯环上只有四种不同化学环境的氢原子;
②能与FeCl3发生显色反应;
③分子中只存在一个环不含其它环状结构。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
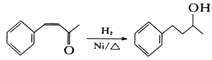 _________________________(无机试剂及溶剂任选)。合成路线流程图示例如下:CH3CHO
_________________________(无机试剂及溶剂任选)。合成路线流程图示例如下:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
【题目】叠氮酸钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体。已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |
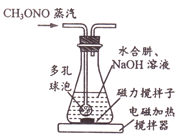
(1)制备NaN3:
30℃时,水合肼(N2H4H2O)与亚硝酸甲酯(CH3ONO)、NaOH反应,装置如右图所示。反应后锥形瓶中混合物经“操作X”可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。
①装置中的多孔球泡的作用是______。
②写出生成NaN3的化学方程式:_________________。
③“操作X”的名称为________________。
(2)测定NaN3产品纯度: ①称取NaN3产品5.0000g,用适量稀硫酸溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入20.00mL0.2000mol/LKMnO4溶液,得紫红色溶液B;
③向溶液B加入足量KI溶液消耗过量的KMnO4溶液,然后以淀粉作指示剂,用0.1000mol/LNa2S2O3标准溶液滴定产生的I2,消耗Na2S2O3溶液30.00mL。测定过程中物质的转化关系如下:
10NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑
I- ![]() I2
I2 ![]() S4O62-
S4O62-
计算NaN3产品的纯度(写出计算过程)。_____________________


