题目内容
20.常温下时,有pH=3的盐酸和醋酸溶液,下列说法正确的是( )| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 | |
| C. | 分别用蒸馏水稀释m倍和n倍,若两溶液pH仍相同,则m>n | |
| D. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) |
分析 醋酸是弱酸,存在电离平衡,pH=3的盐酸和醋酸溶液中氢离子浓度相同,醋酸浓度大于盐酸的浓度,加水稀释促进醋酸电离,氢离子浓度增大抑制醋酸电离,据此分析.
解答 解:A、pH=3的盐酸和醋酸溶液中氢离子浓度相同,对水的电离的抑制作用相同,由水电离出来的c(H+)相同,故A错误;
B、pH=3的盐酸和醋酸溶液中氢离子浓度相同,醋酸浓度大于盐酸的浓度,中和相同体积的两种酸溶液所需NaOH的物质的量醋酸多于盐酸,故B错误;
C、加水稀释促进醋酸电离,盐酸和醋酸用燕馏水稀释m倍和n倍,若两溶液pH仍相同,醋酸加水稀释倍数高,所以则m<n,故C错误;
D、两溶液等体积混合,氢离子浓度不变,温度不变醋酸的电离平衡常数不变,c(CH3COO-)与c(CH3COOH)都变为原浓度的$\frac{1}{2}$,所以醋酸的电离平衡没有移动,则c(H+)=2c(CH3COO-)=2c(Cl-)>c(OH-),将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-),故D正确;
故选D.
点评 本题考查了弱电解质的电离,明确弱电解质的电离特点即可解答,知道影响水电离的因素,知道影响弱酸电离平衡移动的因素,为易错点,题目难度中等.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
10.下列化学用语表述正确的是( )
| A. | 水分子的结构式: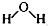 | B. | 氯化钠的电子式: | ||
| C. | 氯气的比例模型: | D. | 硫原子的结构示意图: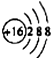 |
11.下列叙述中正确的是( )
| A. | HClO是弱酸,所以NaClO是弱电解质 | B. | 水泥、玻璃、水晶属于硅酸盐材料 | ||
| C. | Na2O2的热稳定性大于NaHCO3 | D. | 金属钠着火时可用泡沫灭火器灭火 |
9.在一盛有22.4L(标准状况下)CO2和CO混合气体的密闭容器中投入1molNa2O2固体,用间断的电火花引发至恰好完全反应,下列对反应完全后容器里剩余固体的叙述正确的是( )
| A. | 1molNa2CO3 | B. | 0.5molNa2CO3,0.5 molNa2O2 | ||
| C. | 0.25molNa2CO3,0.75 molNa2O2 | D. | O.75 molNa2CO3,0.25 molNa2O2 |
10.已知反应:①2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,反应热要有正负号,中和热不用,弱酸的中和热减少,下列结论正确的是( )
| A. | 碳的燃烧热大于110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
 ,该物质分子中所含的官能团有氨基、羧基(填写名称).
,该物质分子中所含的官能团有氨基、羧基(填写名称).