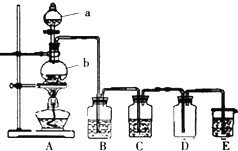
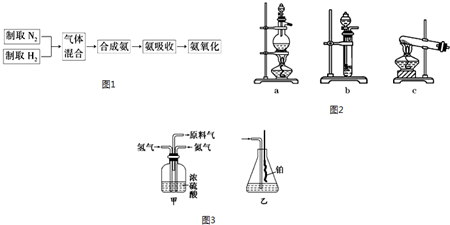
题目内容
14.已知下列物质在20℃下的Ksp如下,试回答下列问题| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br−)c(Cl−)=2.7×10-3.
(3)测定水体中氯化物含量,常用标准硝酸银法进行滴定,滴定时应加入的指示剂_A.
A.K2CrO4 B.KI C.KCl D.KBr.
分析 (1)依据溶度积常数计算银离子浓度比较判断;
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时依据氯化银和溴化银的溶度积可知,氯化银溶解度大于溴化银,依据氯化银和溴化银的溶度积计算和沉淀转化关系计算得到;
(3)测定水体中氯化物的含量,必须使氯离子完全生成白色沉淀,指示沉淀反应完全的试剂溶解性一定小于氯化银,所以本题应在Ag+和Cl-生成AgCl沉淀后,再生成不同颜色沉淀指示沉淀终点,则指示剂的溶解度应比AgCl大来分析判断.
解答 解:(1)20℃时,上述三种银盐饱和溶液中,Ag+物质的量浓度可以计算得到:①Ksp(AgCl)=c(Ag+)×c(Cl-)=2.0×10-10,c(Ag+)=√2×10−10;②Ksp(AgBr)=c(Ag+)×c(Br-)=5.4×10-13,c(Ag+)=√5.4×10−13;③Ksp(AgI)=c(Ag+)×c(I-)=8.3×10-17,c(Ag+)=√8.3×10−17;④Ksp(Ag2CrO4)=c(Ag+)2×c(CrO42-)4=2.0×10-12,c(Ag+)=\root{3}{2.0×1{0}^{-12}},
所以三种银盐的饱和溶液中,Ag+物质的量浓度由大到小的顺序是:Ag2CrO4>AgCl>AgBr>AgI>Ag2S,
故答案为:Ag2CrO4>AgCl>AgBr>AgI>Ag2S;
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,依据溶度积常数判断AgBr的溶解度小于AgCl溶解度,AgCl+Br-=AgBr+Cl-;Ksp=c(Ag+)×c(Cl-),Ksp=c(Ag+)×c(Br-),所以,c(Br−)c(Cl−)=Ksp(AgBr)Ksp(AgCl)=5.4×10−32.0×10−10=2.7×10-3,
故答案为:2.7×10-3;
(3)A.铬酸银的阳、阴离子个数比为2:1,可以计算相同浓度的银离子沉淀氯离子、铬酸根离子需要的浓度,依据Ksp计算得到,Ksp(AgCl)=[Ag+][Cl-]=1.5×10-4,Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=4.3×10-2,[Cl-]=√1.5×10−4,[CrO42-]=√4.3×10−22;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4,做指示剂可以正确的测定氯化物的含量,故A正确;
B.氯化银、溴化银、碘化银的组成都是1:1,依据Ksp可以直接比较溶解性大小为氯化银>溴化银>碘化银;随Ksp的减小,应先出现碘化银沉淀、再出现溴化银,最后才沉淀氯化银,碘化银优先于氯化银析出,不能测定氯化物的含量,故B错误;
C.滴定氯离子,氯化钾中含有氯离子,影响了测定,不能使用氯化钾,故C错误;
D.根据B可知,先析出溴化银沉淀,所以不符合滴定实验的目的和作用,不能测定氯化物的含量,故D错误;
故答案为:A.
点评 本题考查了难溶物溶解平衡及溶度积的计算,题目难度中等,明确溶度积的概念及计算方法为解答关键,试题侧重考查学生的分析能力及化学计算能力.

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案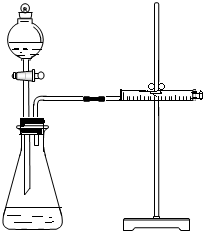 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
(2)甲同学的实验目的是探究探究反应物本身的性质对反应速率的影响.
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定同一金属与浓度不同但体积相同的硫酸产生一定体积的气体所需要的时间于(或在一定时间内产生气体的体积).
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
| A. | 反应C(s)+CO2(g)═2CO(g)的△H>0,△S<0 | |
| B. | 反应H+(aq)+OH-(aq)═H2O(l)的△H<0,△S<0 | |
| C. | 反应NH3(g)+HCl(g)═NH4Cl(s) 在低温下能自发进行,则该反应△H>0 | |
| D. | 反应CaCO3(s)═CaO(s)+CO2(g) 室温下不能自发进行,则该反应△H<0 |
| A. | 钙离子的结构示意图: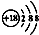 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | CH4分子的球棍模型: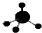 | D. | -CH3(甲基)的电子式为: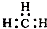 |
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(2)丙同学认为甲、乙的判断都不充分.丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B.
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
②将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则甲(填“甲”或“乙”)判断正确.
③查阅资料,发现NaHCO3的分解温度为150℃,丙断言乙(填“甲”或“乙”)判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
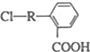 (其中R为饱和烃基),X在一定条件下如图所示的转化关系,已知Q的蒸气密度是相同条件下H2密度的74倍,分子组成符号CaHbO2
(其中R为饱和烃基),X在一定条件下如图所示的转化关系,已知Q的蒸气密度是相同条件下H2密度的74倍,分子组成符号CaHbO2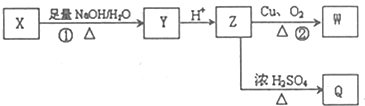
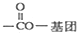 ),写出任意一种能发生银镜反应的符合上述条件的物质的结构简式
),写出任意一种能发生银镜反应的符合上述条件的物质的结构简式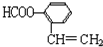
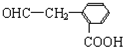 .于由X通过一步反应得到P,该反应的化学方程式是
.于由X通过一步反应得到P,该反应的化学方程式是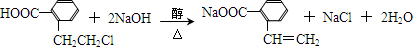
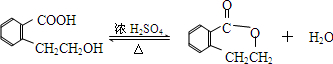 .
.