题目内容
【题目】硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,是一种复盐(又称摩尔盐)。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体,三种盐的溶解度(单位为g/100gH2O)见下表:
温度℃ | FeSO4·7H2O | (NH4)2SO4 | (NH4)2SO4·FeSO4·6H2O |
10 | 20.0 | 73.0 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78.0 | 28.1 |
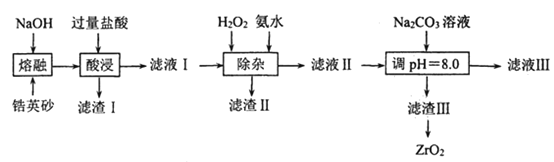
实验用品:10%Na2CO3溶液、Fe屑、3molH2SO4、(NH4)2SO4、蒸馏水、无水乙醇。实验步骤流程如图所示:
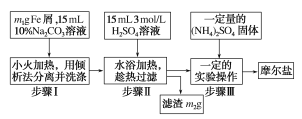
(1)步骤Ⅰ加入10%Na2CO3溶液的作用是__。
(2)下列情况适合倾析法的有__。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤Ⅲ中加入(NH4)2SO4后要得到摩尔盐晶体,需要经过的实验操作包括加热蒸发、__、__。
(4)得到的晶体需要用乙醇洗涤的目的是__。
(5)已知摩尔盐晶体在100℃~110℃时分解,分解的产物中除固体外,还可能含有SO3(g)、SO2(g)及N2(g)。甲同学用如图所示装置设计实验,探究摩尔盐晶体加热分解时可能产生的气体产物。
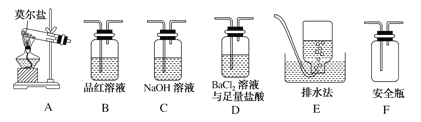
①甲同学的实验中,装置依次连接的合理顺序为:A→F→(____________)→(____________)→C→E。
②证明含有SO3的实验现象是__。
(6)为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成500mL溶液。通过测定NH4+设计实验装置如图所示。取25.00mL样品溶液进行该实验。
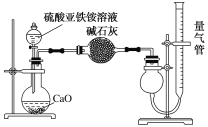
①该方案中量气管中最佳试剂是__。
a.水 b.饱和NaHCO3溶液 c.CCl4 d.饱和食盐水
②该方案中收集完气体并恢复至室温,读数前应进行的操作是__。
③设该样品中NH4+完全转化为NH3且忽略溶解损耗,测得NH3的体积为VL(已折算为标准状况下),则该摩尔盐样品中硫酸亚铁铵纯度为__(用含m、V的代数式表示,(NH4)2SO4·FeSO
【答案】除去铁表面的油污 AB 冷却结晶 过滤 减少晶体的损失和除去晶体表面的水分 D B D中有白色沉淀生成 c 调整量气管的高度(或上下移动量气管)使两侧的液面相平 ![]() ×100%或
×100%或![]() ×100%
×100%
【解析】
热的Na2CO3溶液因为水解程度较大,碱性较强,能促进油污的水解而除去。因为硫酸亚铁铵几乎不溶于乙醇,为防止硫酸亚铁铵损失,不用水洗,过滤后用无水乙醇洗涤晶体。根据氧化还原反应电子得失相等可得对应关系:KMnO4—5Fe2+,由此回答问题。
(1)铁屑表面有油污,将铁屑在Na2CO3溶液中加热,Na2CO3溶液水解显碱性,可使铁屑上附着的油污水解,故步骤Ⅰ加入10%Na2CO3溶液的作用是除去铁表面的油污。
(2)倾析法要求沉淀的颗粒较大,沉淀容易沉降,选AB;
(3)步骤Ⅲ中加入(NH4)2SO4后要得到摩尔盐晶体,需要经过的实验操作包括加热蒸发、冷却结晶和过滤;
(4)硫酸亚铁铵几乎不溶于乙醇,为防止硫酸亚铁铵损失,过滤后用无水乙醇洗涤晶体,故得到的晶体需要用乙醇洗涤的目的是减少晶体的损失和除去晶体表面的水分。
(5)用酸性BaCl2溶液检验生成的SO3,用品红检验生成的SO2,排水法收集生成的N2。
①甲同学的实验中,装置依次连接的合理顺序为:A→F→D→B→C→E。
②三氧化硫溶于水生成硫酸根,与钡离子结合产生沉淀,证明含有SO3的实验现象是D中有白色沉淀生成;
(6)①加入NaOH溶液与NH4+反应,通过测定生成氨气的体积来测定硫酸亚铁铵纯度,①因NH3极易溶于水、不溶于四氯化碳,该方案中量气管中最佳试剂是CCl4,选C;
②该方案中收集完气体并恢复至室温,读数前应进行的操作是调整量气管的高度使两侧的液面相平。
③设该样品中NH4+完全转化为NH3且忽略溶解损耗,测得NH3的体积为VL(已折算为标准状况下),即氨气物质的量为![]() mol,(NH4)2SO4·FeSO4·6H2O的物质的量为
mol,(NH4)2SO4·FeSO4·6H2O的物质的量为![]() mol,
mol,
则该摩尔盐样品中硫酸亚铁铵纯度为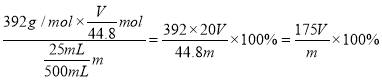 。
。

【题目】汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾天气的主要成因之一。
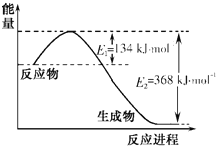
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=__。
②请写出CO和NO生成无污染气体的热化学方程式为__。
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g)![]() 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
时间(min) 浓度(mol/L) 实验序号/温度 | 0 | 10 | 20 | 30 | 40 | 50 |
实验1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
实验2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
实验3/850℃ | 1.00 | 0.50 | 0.40 | 0.35 | 0.35 | 0.35 |
①下列说法正确的是__。
A.实验2容器内压强比实验1的小
B.在0→10mim内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是__。
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,平衡将__(填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
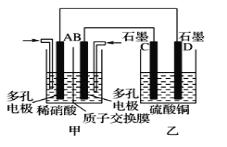
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为__(填化学式);A电极的电极反应式为__。