题目内容
【题目】ZrO2常用陶瓷材料,可由锆英砂(主要成分为ZrSiO4, 也可表示为ZrO2SiO2还含少量FeCO3、Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
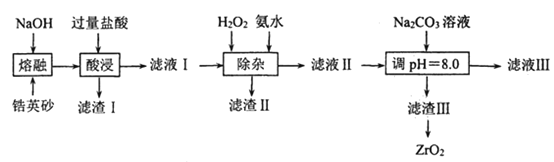
已知:①ZrSiO4能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+;
②常温下,Ksp[Fe(OH)3= 1×10-38,Ksp [(Al(OH)3= 1×10-32;pH=6.2时,ZrO2+开始沉淀.
(1)“熔融”过程中 ,ZrSiO4发生反应的化学方程式为______________________;滤渣 I的化学式为________________________。
(2)“除杂”过程中,加入双氧水的目的是________________:此过程中为使滤液I中的杂质离子沉淀完全而除去(当离子浓度c≤1×10-5 molL-1时即为沉淀完全) ,室温下加氪水调节pH范围为____________________。
(3)为得到纯净的ZrO2滤渣III要用水洗,检验沉淀是否洗涤干净的方法是_______。
(4)滤渣III的成分是Zr(CO3)2 nZr(OH)4。“调 pH=8.0”时,所发生反应的离子方程式为_______________________;滤渣III制备ZrO2的方法是_____________。
【答案】ZrSiO4+4NaOH![]() Na2SiO3+Na2ZrO3+2H2O H2SiO3 将Fe2+氧化为Fe3+,以便转化为Fe(OH)3沉淀除去 5≤pH<6.2 取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净 (n+1)ZrO2++2nCO32-+(3n-1)H2O=Zr(CO3)2nZr(OH)4↓+(2n-2)HCO3 - 高温焙烧
Na2SiO3+Na2ZrO3+2H2O H2SiO3 将Fe2+氧化为Fe3+,以便转化为Fe(OH)3沉淀除去 5≤pH<6.2 取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净 (n+1)ZrO2++2nCO32-+(3n-1)H2O=Zr(CO3)2nZr(OH)4↓+(2n-2)HCO3 - 高温焙烧
【解析】
锆英砂(主要成分为 ZrSiO4,还含少量FeCO3、Fe2O3、Al2O3、SiO2等杂质),加NaOH熔融,ZrSiO4转化为Na2SiO3和Na2ZrO3,氧化铝转化为NaAlO2,SiO2转化为Na2SiO3,Fe2O3不反应,再加过量盐酸酸浸,Na2ZrO3与酸反应生成ZrO2+,Na2SiO3与HCl生成硅酸沉淀,偏铝酸钠转化为氯化铝、碳酸亚铁、氧化铁转化为氯化亚铁、氯化铁,过滤分离,滤渣I为硅酸,滤液中含有ZrO2+、Fe2+、Fe3+、Al3+,Na+、Cl-等,加入过氧化氢氧化亚铁离子,加氨水调节pH,使Fe3+、Al3+转化为氢氧化物沉淀,过滤分离滤渣II为氢氧化铁、氢氧化铝,滤液中主要含有ZrO2+、NH4+、Cl-,Na+、Cl-等,再加氨水调节pH,使ZrO2+转化为Zr(OH)4沉淀,过滤、洗涤、干燥得到Zr(OH)4,加热分解即可得到ZrO2,以此解答该题。
(1)高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3,其反应的方程式为:ZrSiO4+4NaOH![]() Na2SiO3+Na2ZrO3+2H2O,加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,过滤,滤渣I为H2SiO3;
Na2SiO3+Na2ZrO3+2H2O,加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,过滤,滤渣I为H2SiO3;
(2)“除杂”过程中,加入双氧水的目的是将Fe2+氧化为Fe3+,以便转化为Fe(OH)3沉淀除去;加氪水调节pH的目的是使Al3+和Fe3+完全转化为沉淀,但ZrO2+不沉淀,由Ksp[Fe(OH)3= 1×10-38,可知Fe3+完全沉淀时溶液中c(OH-)=![]() mol/L=1×10-11 mol/L,此时溶液pH=3;Ksp [(Al(OH)3]= 1×10-32,可知Al3+完全沉淀时溶液中c(OH-)=
mol/L=1×10-11 mol/L,此时溶液pH=3;Ksp [(Al(OH)3]= 1×10-32,可知Al3+完全沉淀时溶液中c(OH-)=![]() mol/L=1×10-9 mol/L,此时溶液pH=5,再结合pH= 6.2时,ZrO2+ 开始沉淀,则调节pH范围为5≤pH<6.2;
mol/L=1×10-9 mol/L,此时溶液pH=5,再结合pH= 6.2时,ZrO2+ 开始沉淀,则调节pH范围为5≤pH<6.2;
(3) Zr(OH)4表面为附着Cl-等,检验Zr(OH)4是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净;
(4) “调pH=8.0”时,反应生成Zr(CO3)2nZr(OH)4,则所发生反应的离子方程式为(n+1)ZrO2++2nCO32-+(3n-1)H2O=Zr(CO3)2nZr(OH)4↓+(2n-2)HCO3-;滤渣III为Zr(OH)4,高温焙烧分解即可得到ZrO2。

【题目】硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,是一种复盐(又称摩尔盐)。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体,三种盐的溶解度(单位为g/100gH2O)见下表:
温度℃ | FeSO4·7H2O | (NH4)2SO4 | (NH4)2SO4·FeSO4·6H2O |
10 | 20.0 | 73.0 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78.0 | 28.1 |
实验用品:10%Na2CO3溶液、Fe屑、3molH2SO4、(NH4)2SO4、蒸馏水、无水乙醇。实验步骤流程如图所示:
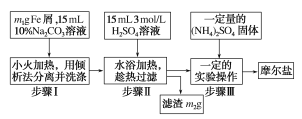
(1)步骤Ⅰ加入10%Na2CO3溶液的作用是__。
(2)下列情况适合倾析法的有__。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤Ⅲ中加入(NH4)2SO4后要得到摩尔盐晶体,需要经过的实验操作包括加热蒸发、__、__。
(4)得到的晶体需要用乙醇洗涤的目的是__。
(5)已知摩尔盐晶体在100℃~110℃时分解,分解的产物中除固体外,还可能含有SO3(g)、SO2(g)及N2(g)。甲同学用如图所示装置设计实验,探究摩尔盐晶体加热分解时可能产生的气体产物。
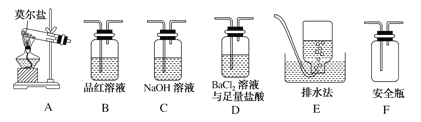
①甲同学的实验中,装置依次连接的合理顺序为:A→F→(____________)→(____________)→C→E。
②证明含有SO3的实验现象是__。
(6)为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成500mL溶液。通过测定NH4+设计实验装置如图所示。取25.00mL样品溶液进行该实验。
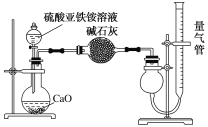
①该方案中量气管中最佳试剂是__。
a.水 b.饱和NaHCO3溶液 c.CCl4 d.饱和食盐水
②该方案中收集完气体并恢复至室温,读数前应进行的操作是__。
③设该样品中NH4+完全转化为NH3且忽略溶解损耗,测得NH3的体积为VL(已折算为标准状况下),则该摩尔盐样品中硫酸亚铁铵纯度为__(用含m、V的代数式表示,(NH4)2SO4·FeSO