��Ŀ����
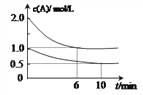
����Ŀ��ͼa��1 mol NO2��1 mol COǡ�÷�Ӧ����CO2��NO�����е������仯ʾ��ͼ����������̶����ܱ�������ͨ������ʵ�����NO2 ��CO����Ӧ�е�CO��NO��Ũ����ʱ��仯��ʾ��ͼ��bͼ������ͼ��ش��������⣺
a 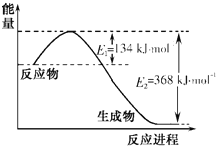 b
b
(1)д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ_____________________________________��
(2)�ӷ�Ӧ��ʼ��ƽ�⣬��NO2Ũ�ȱ仯��ʾƽ����Ӧ����v(NO2)��_____________��
(3)���¶��¸÷�Ӧ��ƽ�ⳣ��K=___________��
(4)830Kʱ�����ܱ������з������п��淴Ӧ��CO��g��+H2O��g��![]() CO2��g��+H2��g����H��0���Իش��������⣺
CO2��g��+H2��g����H��0���Իش��������⣺
������ʼʱc��CO��=2mol��L-1��c��H2O��=3mol��L-1���ﵽƽ��ʱCO��ת����Ϊ60%�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K=____________��
������ͬ�¶��£�����ʼʱc��CO��=1mol��L-1��c��H2O��=2mol��L-1����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5mol��L-1�����ʱ�÷�Ӧ�Ƿ�ﵽƽ��״̬______����ǡ��롰������ʱv������____v���棩������ڡ���С�ڡ����ڡ�����
���𰸡�NO2(g) + CO(g) ![]() NO(g) + CO2(g) ��H= -234 mol��L-1 1.50/t1 mol��L��1��min��1 9 1 �� ��
NO(g) + CO2(g) ��H= -234 mol��L-1 1.50/t1 mol��L��1��min��1 9 1 �� ��
��������
��1����ͼa��֪�÷�Ӧ���ʱ��H=E1-E2=134kJ/mol-368kJ/mol=-234kJ/mol��
��2����ͼb�����ȼ���v��NO��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��NO2����
��3����ͼb�����ȼ��������ƽ��ʱ��Ũ�ȣ�������ƽ�ⳣ����ʽ����ƽ�ⳣ����
��4��������������Ƚ�������ʽ���������ƽ��ʱ��Ũ�ȣ�������ƽ�ⳣ����ʽ����ƽ�ⳣ����
������������Ƚ�������ʽ��������ʵ�Ũ�ȵõ�Ũ���أ�������Ũ���غ�ƽ�ⳣ������Դ�С�ж�ƽ���ƶ�����
��1����ͼa��֪�÷�Ӧ���ʱ��H=E1-E2=134kJ/mol-368kJ/mol=-234kJ/mol����CO��NO2��Ӧ���Ȼ�ѧ����ʽΪ��NO2��g��+CO��g��![]() CO2��g��+NO��g����H=-234kJmol-1���ʴ�Ϊ��NO2��g��+CO��g��
CO2��g��+NO��g����H=-234kJmol-1���ʴ�Ϊ��NO2��g��+CO��g��![]() CO2��g��+NO��g����H=-234kJmol-1��
CO2��g��+NO��g����H=-234kJmol-1��
��2����ͼb��֪��t1min����ƽ�⣬ƽ��ʱNO��Ũ�ȱ仯��Ϊ1.5mol/L����v��NO��=![]() =
=![]() molL-1min-1������֮�ȵ��ڻ�ѧ������֮�ȣ���v��NO2��=v��NO��=
molL-1min-1������֮�ȵ��ڻ�ѧ������֮�ȣ���v��NO2��=v��NO��=![]() molL-1min-1���ʴ�Ϊ��
molL-1min-1���ʴ�Ϊ��![]() molL-1min-1��
molL-1min-1��
��3����ͼb��֪��ƽ��ʱCO��NO2��Ũ�Ⱦ�Ϊ0.5mol/L��CO2��NO��Ũ�Ⱦ�Ϊ1.5mol/L����Ӧ��ƽ�ⳣ��K=![]() =
=![]() =9���ʴ�Ϊ��9��
=9���ʴ�Ϊ��9��
��4������������ݿɽ�����������ʽ��
CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
��mol/L�� 2 3 0 0
�䣨mol/L�� 1.2 1.2 1.2 1.2
ƽ��mol/L�� 0.8 1.8 1.2 1.2
��Ӧ��ƽ�ⳣ��K=![]() =
=![]() =1���ʴ�Ϊ��1��
=1���ʴ�Ϊ��1��
����������ݿɽ�����������ʽ��
CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
��mol/L�� 1 2 0 0
�䣨mol/L�� 0.5 0.5 0.5 0.5
ĩ��mol/L�� 0.5 1.5 0.5 0.5
���ʱ�÷�Ӧ��Ũ����Qc=![]() =
=![]() =
=![]() ��K=1����ƽ��������Ӧ�����ƶ���v��������v���棩���ʴ�Ϊ������
��K=1����ƽ��������Ӧ�����ƶ���v��������v���棩���ʴ�Ϊ������

����Ŀ������������������ʵ����������������������泥�(NH4)2SO4��FeSO4��6H2O����һ�ָ���(�ֳ�Ħ����)��һ���������ڿ������ױ������������γɸ��κ�ͱȽ��ȶ�������������һ���������������ˮ�е��ܽ�ȱ��������ÿһ���ε��ܽ�ȶ�С���Ҽ����������Ҵ���������һ���ʿ�����ȡ��������茶��壬�����ε��ܽ��(��λΪg/100gH2O)���±���
�¶ȡ� | FeSO4��7H2O | (NH4)2SO4 | (NH4)2SO4��FeSO4��6H2O |
10 | 20.0 | 73.0 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78.0 | 28.1 |
ʵ����Ʒ��10%Na2CO3��Һ��Feм��3molH2SO4��(NH4)2SO4������ˮ����ˮ�Ҵ���ʵ�鲽��������ͼ��ʾ��
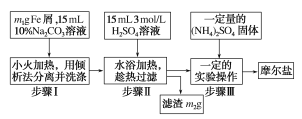
��1����������10%Na2CO3��Һ��������__��
��2����������ʺ�����������__��
A.�����Ŀ����ϴ� B.�������׳��� C.�����ʽ�״ D.��������״
��3��������м���(NH4)2SO4��Ҫ�õ�Ħ���ξ��壬��Ҫ������ʵ�������������������__��__��
��4���õ��ľ�����Ҫ���Ҵ�ϴ�ӵ�Ŀ����__��
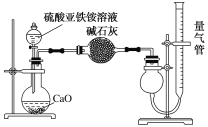
��5����֪Ħ���ξ�����100�桫110��ʱ�ֽ⣬�ֽ�IJ����г������⣬�����ܺ���SO3(g)��SO2(g)��N2(g)����ͬѧ����ͼ��ʾװ�����ʵ�飬̽��Ħ���ξ�����ȷֽ�ʱ���ܲ�����������
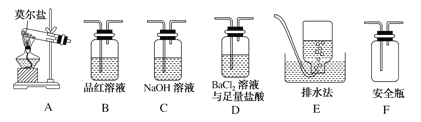
�ټ�ͬѧ��ʵ���У�װ���������ӵĺ���˳��Ϊ��A��F����____________������____________����C��E��
��֤������SO3��ʵ��������__��
��6��Ϊ�ⶨ��������林��ȣ���ȡmgĪ������Ʒ�����500mL��Һ��ͨ���ⶨNH4+���ʵ��װ����ͼ��ʾ��ȡ25.00mL��Ʒ��Һ���и�ʵ�顣
�ٸ÷�����������������Լ���__��
a.ˮ b.����NaHCO3��Һ c.CCl4 d.����ʳ��ˮ
�ڸ÷������ռ������岢�ָ������£�����ǰӦ���еIJ�����__��
�������Ʒ��NH4+��ȫת��ΪNH3�Һ����ܽ���ģ����NH3�����ΪVL��������Ϊ��״���£������Ħ������Ʒ����������林���Ϊ__���ú�m��V�Ĵ���ʽ��ʾ��(NH4)2SO4��FeSO