题目内容
【题目】用一种硫化矿(含45%SiO2、20.4% Al2O3、30%FeS和少量GeS2等)制取盆景肥料NH4Fe(SO4)2及铝硅合金材料的工艺流程如下 :
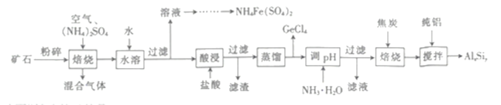
(1)“矿石”粉碎的目的是_____________________ 。
(2)“混合气体”经过水吸收和空气氧化能再次利用。
①“焙烧”时,GeS2发生反应的化学方程式为____________________。
②“混合气体”的主要成分是_______________ (填化学式).
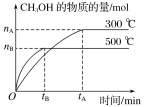
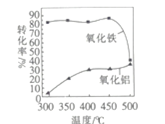
③FeS焙烧产生的Fe2O3会与(NH4)2SO4反应生成NH4Fe(SO4)2,该反应的化学方程式为_______________。 Al2O3也能发生类似反应.这两种氧化物转化为硫酸盐的转化率与温度的关系如图,上述流程中最适宜的“焙烧” 温度为_____________________。
(3)GeCl4的佛点低,可在酸性条件下利用蒸馏的方法进行分离,酸性条件的目的是_________。
(4)用电解氧化法可以增强合金 AlxSiy的防腐蚀能力,电解后在合金表面形成致密、耐腐蚀的氧化膜(主要成分为Al2O3), 电解质溶液为 H2SO4-H2C2O4混合溶液,阳极的电极反应式为______________________。
(5)假设流程中SiO2 损失了20%,Al2O3 损失了25%,当投入1 t硫化矿,加入了54kg纯铝时,铝硅合金中x:y=______________。
【答案】使矿石充分灼烧 GeS2+3O2![]() GeO2+2SO2 SO2、NH3 4(NH4)2SO4+Fe2O3
GeO2+2SO2 SO2、NH3 4(NH4)2SO4+Fe2O3![]() 2NH4Fe(SO4)2+3H2O+6NH3↑ 300℃ 防止GeCl4水解 2Al-6eˉ+3H2O =Al2O3+6H+ 5:6
2NH4Fe(SO4)2+3H2O+6NH3↑ 300℃ 防止GeCl4水解 2Al-6eˉ+3H2O =Al2O3+6H+ 5:6
【解析】
硫化矿(含45%SiO2、20.4% Al2O3、30%FeS和少量GeS2等)粉碎后加入硫酸铵在空气中焙烧,-2价S被氧化生成SO2,Ge元素转化为GeO2,FeS焙烧产生的Fe2O3会与(NH4)2SO4反应生成NH4Fe(SO4)2,控制焙烧温度,防止Al2O3也发生类似的反应;加水后,NH4Fe(SO4)2溶解,经系列处理得到NH4Fe(SO4)2;过滤得到滤渣为SiO2、Al2O3和GeO2,加盐酸溶解,Al2O3和GeO2得到的相应的氯化物,二氧化硅不溶解,过滤得到二氧化硅滤渣;蒸馏分离滤液中的GeCl4后再加入氨水调节pH得到Al(OH)3沉淀,过滤取Al(OH)3沉淀,与前序滤渣SiO2和焦炭高温焙烧还原得到Al和Si,再加纯铝搅拌得到合金。
(1)矿石粉碎后可以增大与空气的接触面积,使矿石充分灼烧;
(2)①“焙烧”时,GeS2中-2价S被氧化生成SO2,Ge元素转化为GeO2,方程式为GeS2+3O2![]() GeO2+2SO2;
GeO2+2SO2;
②混合气体中主要有硫元素被氧化生成的SO2,以及铵盐分解产生的NH3;
③Fe2O3会与(NH4)2SO4反应生成NH4Fe(SO4)2,该反应为非氧化还原反应,根据元素守恒可得方程式为4(NH4)2SO4+Fe2O3![]() 2NH4Fe(SO4)2+3H2O+6NH3↑;因流程的目的是要是制备NH4Fe(SO4)2和硅铝合金,所以要使Fe2O3尽量反应,而Al2O3不反应,据图可知300℃时大部分氧化铁转化为硫酸盐,只有极少量氧化铝转化为硫酸盐,所以最合适的温度为300℃;
2NH4Fe(SO4)2+3H2O+6NH3↑;因流程的目的是要是制备NH4Fe(SO4)2和硅铝合金,所以要使Fe2O3尽量反应,而Al2O3不反应,据图可知300℃时大部分氧化铁转化为硫酸盐,只有极少量氧化铝转化为硫酸盐,所以最合适的温度为300℃;
(3)GeCl4易水解,蒸馏过程中会HCl挥发造成彻底水解,所以需要在酸性条件下防止GeCl4水解,再进行蒸馏;
(4)电解池中阳极失电子发生氧化反应,根据题意可知Al单质被氧化成三氧化二铝,电解质溶液显酸性,所以电极方程式为2Al-6eˉ+3H2O =Al2O3+6H+;
(5)1 t硫化矿中SiO2的质量为1000kg×45%=450kg,流程中损失20%,所以被利用的二氧化硅的质量为450kg×(1-20%)=360kg,则n(Si)=![]() =6000mol;1 t硫化矿中SiO2的质量为1000kg×20.4%=204kg,流程中损失25%,所以被利用的Al2O3的质量为204kg×(1-25%)=153kg,又加入54kg铝,则n(Al)=
=6000mol;1 t硫化矿中SiO2的质量为1000kg×20.4%=204kg,流程中损失25%,所以被利用的Al2O3的质量为204kg×(1-25%)=153kg,又加入54kg铝,则n(Al)=![]() =5000mol,所以合金AlxSiy中x:y=5:6。
=5000mol,所以合金AlxSiy中x:y=5:6。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案