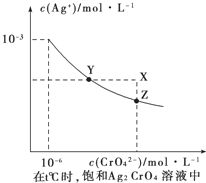
题目内容
【题目】稀土是一种重要的战略资源、氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
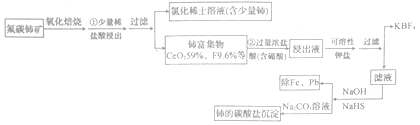
已知:Ⅰ.铈的常见化合价为+3、+4
Ⅱ.Ce4+可以与SO42-结合为[CeSO4]2+
Ⅲ. 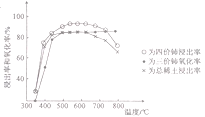
焙烧时铈被氧化成四价,四价铈不易进入溶液,而三价稀土元素易进入溶液。在盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。
回答下列问题:
(1)氟碳铈矿焙烧的目的是__________________;焙烧最适宜温度为______________(填标号)。a.350~450℃ b.550~650℃ C.750℃以上
步骤①中少量铈进入稀土溶液发生反应的离子方程式是_________________________。
(2)铈富集物用含硼酸的盐酸溶液处理,使氟转化为四氟硼酸根离子,然后用可溶性钾盐将四氟硼酸根离子转变为KBF4沉淀并过滤除去。写出生成KBF4的离子方程式:________________。此法处理铈富集物的缺点是____________________。
(3)除云氟离子后向滤液中先加入NaOH溶液,然后再加入NaHS除去铁与铅。加入NaOH溶液的目的是____________________。
(4)写出此流程中铈的碳酸盐沉淀的化学式:______________________。
【答案】 将铈氧化为四价便于与其他稀土元素分离 b 8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O K++BF4-=KBF4↓ 产生的氯气会腐蚀设备、污染环境 调节溶液pH Ce2(CO3)3
【解析】(1) 焙烧时铈被氧化成四价,四价铈不易进入溶液,而三价稀土元素易进入溶液,所以
氟碳铈矿焙烧的目的是将铈氧化为四价便于与其他稀土元素分离。由图分析当温度在500-700之间四价铈的浸出率差不多最高,所以选择b.550~650℃. 步骤①中少量铈进入稀土溶液发生反应的离子方程式是8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O 答案:将铈氧化为四价便于与其他稀土元素分离 b 8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O
(2)铈富集物用含硼酸的盐酸溶液处理,使氟转化为四氟硼酸根离子,然后用可溶性钾盐将四氟硼酸根离子转变为KBF4沉淀并过滤除去。生成KBF4的离子方程式:K++BF4-=KBF4↓。此法处理铈富集物和酸反应8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O产生的氯气会腐蚀设备、污染环境 。
(3)除云氟离子后向滤液中含有大量的H+先加入NaOH调节溶液的酸碱性,然后再加入NaHS使铁与铅生成沉淀析出。所以加入NaOH溶液的目的是调节溶液pH。
(4)除去铁与铅后的滤液中含有大量的Ce3+,所以铈的碳酸盐沉淀的化学式:Ce2(CO3)3。