题目内容
【题目】“低碳经济”备受关注,CO2的捕集、利用与封存成为科学家研究的重要课题。将一定量的CO2(B)和CH4(g)通入一恒容密闭容器中发生反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。回答下列问题:
2CO(g)+2H2(g)。回答下列问题:
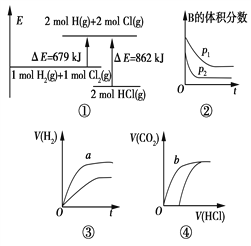
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41 kJ·mol-1
则反应CO2(g)+CH4(g)![]() 2CO(g) +2H2(g)的△H =___________。
2CO(g) +2H2(g)的△H =___________。
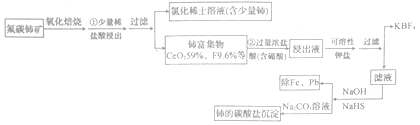
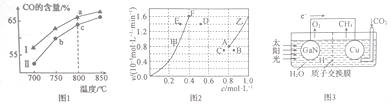
(2)其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下,反应经过相同时间时,体系中CO含量随反应温度的变化如图1所示。
①在a点与c点对应的反应条件下,反应继续进行一段时间后达到平衡,平衡常数K(a 点)________K(c点 )( 填“>”“ <”或“=”)。
②b点CO含量低于c点的原因是____________________。
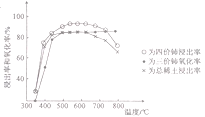
(3)为了探究反应:CO2(g) +CH4(g)![]() 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线____________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为____________(填字母)。
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线____________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为____________(填字母)。
(4)将足量CO2通入饱和氨水中可得氮肥NH4HCO3。在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka2=4×10-11)。
NH3·H2O+H2CO3的平衡常数K=_________(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka2=4×10-11)。
(5)科学家用氮化镓材料与铜组装成如图3所示的人工光合系统,利用该装置成功地实现了用CO2和H2O合成CH4。。氮化镓(GaN)表面发生__________(填“氧化”或“还 原”)反应,铜电极上的电极反应式为______________________。
【答案】 +248kJ·mol-1 = c点温度高于b点,反应速率快,相同时间内生成的CO多 乙 E 1.25×10-8 氧化 CO2+8e-+8H+=CH4+2H2O
【解析】(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802kJ·mol-1 ①
CO(g)+![]() O2(g)=CO2(g) △H2=-283kJ·mol-1 ②
O2(g)=CO2(g) △H2=-283kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41 kJ·mol-1 ③
则反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的△H = ①- ②
2CO(g)+2H2(g)的△H = ①- ②![]() -③
-③![]() 2=-802kJ·mol-1-(-283kJ·mol-1
2=-802kJ·mol-1-(-283kJ·mol-1![]() 4)+(-41 kJ·mol-1
4)+(-41 kJ·mol-1![]() )=+248kJ·mol-1,答案:+248kJ·mol-1。
)=+248kJ·mol-1,答案:+248kJ·mol-1。
(2)因为CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的△H =+248kJ·mol-1①平衡常数只受温度影响,与其他因素无关,而在a点与c点对应的反应温度相同,只是选用的催化剂不同,催化剂只改变反应速率,不影响平衡移动,所以当反应达到平衡K(a点)= K(c点)。答案:=。
2CO(g)+2H2(g)的△H =+248kJ·mol-1①平衡常数只受温度影响,与其他因素无关,而在a点与c点对应的反应温度相同,只是选用的催化剂不同,催化剂只改变反应速率,不影响平衡移动,所以当反应达到平衡K(a点)= K(c点)。答案:=。
②因为c点温度高于b点,反应速率快,相同时间内生成的CO多 ,所以b点CO含量低于c点。答案:c点温度高于b点,反应速率快,相同时间内生成的CO多。
(3) CO2(g) + CH4(g) ![]() 2CO(g)+ 2H2(g)
2CO(g)+ 2H2(g)
起始量(mol·L-1) 1.0 1.0 0 0
随着反应进行,CO2(g) 和CH4(g)的浓度都减小,所以乙图是v正~c(CH4)相对应的曲线。因为CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的△H =+248kJ·mol-1,反应达到平衡后,某一时刻降低温度,平衡向逆反应反向移动,CO(g)和 H2减小,CO2(g)和CH4(g)增大,可能达到E点,
2CO(g)+2H2(g)的△H =+248kJ·mol-1,反应达到平衡后,某一时刻降低温度,平衡向逆反应反向移动,CO(g)和 H2减小,CO2(g)和CH4(g)增大,可能达到E点,
(4) NH4++HCO3-+H2O![]() NH3·H2O+H2CO3 K=[c(H2CO3).c(NH3·H2O)]/[c(NH4+).c(HCO3-)]
NH3·H2O+H2CO3 K=[c(H2CO3).c(NH3·H2O)]/[c(NH4+).c(HCO3-)]
将足量CO2通入饱和氨水中可得氮肥NH4HCO3。在NH4HCO3溶液中,反应的平衡常数,NH3·H2O的电离平衡常数Kb= [c(NH4+).c(OH-)]/(NH3·H2O)=2×10-5,H2CO3的电离平衡常数Ka2=[c(CO32-)c(H+)]/c(HCO3-)=4×10-11)。
(5)原电池中电子从负极流向正极,则Cu电极为正极, 氮化镓(GaN)做负极,其表面发生氧化反应,正极上CO2得电子生成CH4,则铜电极表面的电极反应式为:![]() ;
;
因此,本题正确答案是: 氧化 ![]() ;
;

 阅读快车系列答案
阅读快车系列答案