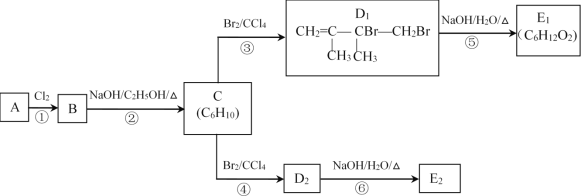
题目内容
【题目】中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3,工艺流程图如下:
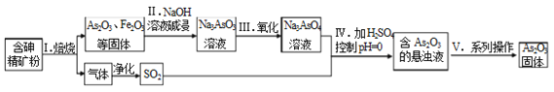
(1)过程 I 中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是_______。
A 工业制硫酸 B 漂白纸张 C 自来水消毒
(2)过程II中发生的反应_______氧化还原反应(填“是”或“不是”)。
(3)过程V中操作为_______(填实验基本操作名称)。
(4)①检验Na3AsO3溶液中是否含有Fe3+的实验操作_______。
②过程IV中生成As2O3的离子反应方程式为_______。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中电解含AsO33-的溶液,阳极的电极反应式为_______。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液100mL。
b.分别移取25.00mL上述溶液,用0.02500mol·L1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2 标准溶液液面读数如图二~图四所示。
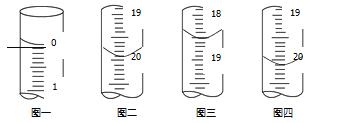
①描述滴定终点的现象_______。
②粗产品中As2O3的质量分数为_______(用含有m的代数式表示)。
【答案】AB 不是 过滤、洗涤、干燥 取Na3AsO3溶液少许,加入少量KSCN溶液,若溶液变为血红色,则说明该溶液中含有Fe3+ 2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O 2OH-+AsO33--2e-=AsO43-+H2O 溶液由无色变为蓝色,且半分钟内不再变化 ![]()
【解析】
(1)SO2可以用来合成硫酸、漂白纸张,但是不能作自来水的消毒剂;
(2)氧化还原反应的特征是化合价的变化,可以从元素的化合价是否变化着手分析;
(3)含As2O3的悬浊液经过滤、洗涤、干燥,可得As2O3固体;
(4)①检验Fe3+,一般使用KSCN溶液,若溶液中有Fe3+,对应的现象是溶液变为血红色;
②过程IV中,SO2和Na3AsO4溶液在H2SO4的所用下反应生成As2O3,据此写出离子方程式;
(5)阳极发生氧化反应,由于电解质溶液呈碱性,故阳极的电极反应为:2OH-+AsO33--2e-=AsO43-+H2O;
(6)①该实验中,I2将AsO33-氧化为 AsO43-,淀粉作指示剂,则滴定终点的现象是溶液由无色变为蓝色,且半分钟内不再变化;
②根据AsO33-~I2,进行相关计算。
(1)SO2可以用来合成硫酸、漂白纸张,但是不能作自来水的消毒剂,故选AB;
(2)Fe2O3不和NaOH溶液反应,As2O3和NaOH溶液反应生成Na3AsO3,这两种含As的化合物中,As都呈+3价,该过程不涉及化合价的变化,则该反应不是氧化还原反应;
(3)由含As2O3的悬浊液得到As2O3固体,需要经过过滤、洗涤、干燥;
(4)①检验Na3AsO3溶液中是否含有Fe3+的实验操作是:取Na3AsO3溶液少许,加入少量KSCN溶液,若溶液变为血红色,则说明该溶液中含有Fe3+;
②过程IV中,SO2和Na3AsO4溶液在H2SO4的所用下反应生成As2O3,相关的离子反应方程式为:2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O;
(5)阳极发生氧化反应,由于电解质溶液呈碱性,故阳极的电极反应为:2OH-+AsO33--2e-=AsO43-+H2O;
(6)①该实验中,I2将AsO33-氧化为 AsO43-,淀粉作指示剂,则滴定终点的现象是溶液由无色变为蓝色,且半分钟内不再变化;
②由图可知,三次滴定所用的溶液体积分别为19.90mL、18.50mL(舍去)、20.10mL,则所用溶液体积平均为20.00mL;则25.00mL的溶液消耗I2 0.5mmol(=20.00mL×0.025mol·L1),由于AsO33-~I2,故25.00mL的溶液中含有0.5mmol AsO33-,则100mL溶液中含有2mmol AsO33-,根据As元素守恒可得,m g粗产品中含1mmol As2O3,故粗产品中As2O3的质量分数为:![]() =
=![]() 。
。