题目内容
【题目】在100mL的稀硝酸中加入由铜和镁组成的2.64g 混合物,两者恰好反应固体完全溶解时收集到0.896L(标准状态)NO气体。向反应后的溶液中加入60mLNaOH溶液中金属离子恰好沉淀完全。下列说法正确的是( )
A.原硝酸溶液的物质的量浓度为1.2mol/L
B.形成的沉淀的质量为4.32g
C.混合物中Cu的质量为1.92g
D.NaOH溶液的物质的量浓度为1mol/L
【答案】C
【解析】
铜和镁都是+2价金属,二者与稀硝酸反应都生成NO气体,根据n=![]()
计算出NO的物质的量,然后设出Cu、Mg的物质的量,利用电子守恒可计算出铜和镁的总物质的量,从而可知生成氢氧化铜、氢氧化镁的物质的量。
硝酸被还原为NO气体且标准状况下体积为0.896L,物质的量为:![]() =0.04mol,所以转移的电子的物质的量为:0.04mol×(5-2)=0.12mol,最后沉淀为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子的物质的量,则沉淀中氢氧根离子的物质的量为0.12mol,所以最后沉淀质量为:2.64g+0.12mol×17g/mol=4.68g,根据氮元素守恒,硝酸的物质的量为0.12+0.04=0.16mol,金属的物质的量为0.06mol,质量为2.64g,设铜的物质的量为xmol,镁的物质的量为ymol,有方程组:x+y=0.06,64x+24y=2.64,计算出x=0.03,y=0.03;加入的氢氧化钠的物质的量为0.12mol。
=0.04mol,所以转移的电子的物质的量为:0.04mol×(5-2)=0.12mol,最后沉淀为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子的物质的量,则沉淀中氢氧根离子的物质的量为0.12mol,所以最后沉淀质量为:2.64g+0.12mol×17g/mol=4.68g,根据氮元素守恒,硝酸的物质的量为0.12+0.04=0.16mol,金属的物质的量为0.06mol,质量为2.64g,设铜的物质的量为xmol,镁的物质的量为ymol,有方程组:x+y=0.06,64x+24y=2.64,计算出x=0.03,y=0.03;加入的氢氧化钠的物质的量为0.12mol。
A、原硝酸溶液的物质的量浓度为![]() =1.6 mol/L,故A错误;
=1.6 mol/L,故A错误;
B、形成的沉淀的质量为4.68g,故B错误;
C、混合物中Cu的质量为0.03mol×64g/mol=1.92g,故C正确;
D、NaOH溶液的物质的量浓度为![]() =2 mol/L,故D错误。
=2 mol/L,故D错误。
答案选C。

【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置中提供的物质完成相关实验,最合理的选项是( )
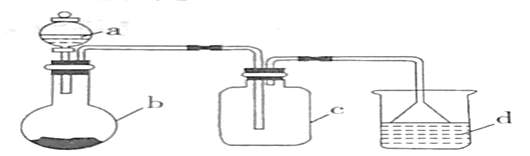
选项 | a中的溶液 | b中的物质 | c中收集的气体 | d中的液体 |
A | 浓氨水 | 生石灰 | NH3 | H2O |
B | 浓硝酸 | 铜片 | NO2 | H2O |
C | 稀硝酸 | 铜片 | NO | NaOH溶液 |
D | 浓硫酸 | 亚硫酸钠 | SO2 | NaOH溶液 |
A.AB.BC.CD.D