题目内容
在一定条件下,已达平衡的可逆反应:2A(g)+B(g)  2C(g),下列说法中正确的是( )
2C(g),下列说法中正确的是( )
| A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K= |
| B.改变条件后,该反应的平衡常数K一定不变 |
| C.如果改变压强并加入催化剂,平衡常数会随之变化 |
| D.若平衡时增加A和B的浓度,则平衡常数会减小 |
A
解析试题分析:由化学平衡常数的表达式可知A对;且化学平衡常数只受温度影响,所以B、C、D错误。
考点:化学平衡常数及其影响因素。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛其化学机理为:
① HUr + H2O  Ur- + H3O+ ②Ur- (aq)+Na+(aq)
Ur- + H3O+ ②Ur- (aq)+Na+(aq)  NaUr(s)
NaUr(s)
(尿酸) (尿酸根离子)
下列对反应②叙述中正确的是( )
| A.反应的△H>0 | B.反应的△H<0 |
| C.升高温度平衡向正反应方向移动 | D.改变温度不影响平衡移动 |
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH2
③Sn(s,灰) 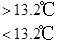 Sn(s,白) ΔH3=+2.1 kJ·mol-1
Sn(s,白) ΔH3=+2.1 kJ·mol-1
下列说法正确的是 ( )
| A.ΔH1>ΔH2 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
| D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏 |
下列说法正确的是( )
| A.增大反应物的量化学反应速率一定加快 |
| B.升高温度可使放热反应速率减慢,吸热反应速率加快 |
| C.增大压强化学反应速率一定加快 |
| D.使用催化剂能加快反应速率 |
反应2A(g) 2B(g)+C(g)△H>0达平衡时,要使v(正)降低,A的浓度增大,应采取的措施是( )
2B(g)+C(g)△H>0达平衡时,要使v(正)降低,A的浓度增大,应采取的措施是( )
| A.加压 | B.减压 | C.减小C的浓度 | D.降温 |
下列说法中正确的是( )
| A.凡是放热反应都是自发的,由于吸热反应都是非自发的 |
| B.自发反应在恰当条件下才能实现 |
| C.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
| D.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
在1 000 K时,已知反应Ni(s)+H2O(g)  NiO(s)+H2(g)的平衡常数K=0.059,当水蒸气和氢气的物质的量浓度相等时,此反应
NiO(s)+H2(g)的平衡常数K=0.059,当水蒸气和氢气的物质的量浓度相等时,此反应
| A.已达平衡状态 | B.未达平衡状态,反应正向进行 |
| C.未达平衡状态,反应逆向进行 | D.无法确定 |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | H2O/ mol |
| 0 | 1.2 | 0.6 |
| t1 | 0.8 | |
| t2 | | 0.2 |
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)=0.4/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.6 molCO和1.2 molH2O,到达平衡时,c(CO2)=0.2 mol·L-1。
C.保持其他条件不变,向平衡体系中再通入0.6 mol H2O,与原平衡相比,达到新平衡时H2的体积分数增大
D.温度降至550℃,上述反应平衡常数为1.26,则正反应为吸热反应