题目内容
下列措施不能达到节能减排目的的是( )
| A.利用太阳能制氢燃料 | B.用家用汽车代替公交车 |
| C.利用潮汐能发电 | D.用节能灯代替白炽灯 |
B
解析试题分析:A、利用太阳能制氢燃料,是节能同时减少污染气体排放,故A能节能减排;B、用家用汽车代替公交车,不能节能减排,反而增加了汽车尾气的排放,故B不能节能减排;C、利用潮汐能发电,潮汐是一种绿色能源,利用潮汐发电,又可以节省资源,同时减少了气体的排放,故C能节能减排;D、用节能灯代替白炽灯,消耗相同电力的条件下,节能灯的发光效率比白炽灯更高,能节能,间接减少污染气体排放,故D能节能减排。
考点:使用化石燃料的利弊及新能源的开发 。

 名校课堂系列答案
名校课堂系列答案在一定条件下,CO和CH4燃烧的热化学方程式分别为:2CO(g)+O2(g) =2CO2(g)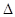 H=" -566" kJ/mol,CH4(== CO2(g) + 2H2O(l)
H=" -566" kJ/mol,CH4(== CO2(g) + 2H2O(l) 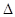 H=" -890" kJ/mol, 由1molCO和3molCH4组成的混合气体在上述条件下完全燃烧时,释放的热量为
H=" -890" kJ/mol, 由1molCO和3molCH4组成的混合气体在上述条件下完全燃烧时,释放的热量为
| A.2912 kJ | B.2953 kJ | C.3236 kJ | D.3867 kJ |
已知:H+(aq)+OH-(aq) =H2O(l); △H=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol·L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,,则△H1、△H2和△H3的大小关系为
| A.△H1=△H2 | B.△H2>△H1 |
| C.△H3>△H2 | D.△H1>△H3 |
已知H2O(g)= H2O(l) △H1=Q1 kJ/mol
C2H5OH(g) = C2H5OH(l), △H2=Q2 kJ/mol
C2H5OH(g)+3O2(g) =2CO2(g) + 3H2O(g), △H3=Q3 kJ/mol
若使用23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )kJ
| A.Q1 +Q2 +Q3 | B.0.5(Q1 +Q2 +Q3) |
| C.0.5Q1 –0.5Q2 +0.5Q3 | D.1.5Q1 –0.5Q2 +0.5Q 3 |
有关热化学方程式书写与对应表述均正确的是( )
| A.稀硫酸与0.1 mol·L-1NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l) △H =" -57.3" kJ·mol-1 |
| B.在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1, 则水分解的热化学方程式: 2H2O(l)=2H2(g)+O2(g)△H = +285.5 kJ·mol-1 |
| C.已知2C(s)+O2(g)=2CO(g)△H=-221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1 |
| D.1mol氢气完全燃烧生成液态水放热为285.8kJ,则氢气燃烧的热化学方程式为 |
下列与化学反应能量变化相关的叙述正确的是( )
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
下列有关热化学方程式的叙述中,正确的是 ( )
| A.含20.0g NaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中[和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ/mol |
B.已知热化学方程式:SO2(g)+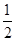 O2(g) O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ |
| C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| D.已知①S(s)+O2(g)=SO2(g); △H1②S(g)十O2(g)=SO2(g);△H2 则△H1>△H2 |
有关能量的判断或表示方法正确的是
| A.由:H+(aq) + OH-(aq) = H2O(l)△H = -57.3kJ/mol,可知:含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,放出热量大于57.3 kJ |
| B.从C(石墨)= C(金刚石) △H =" +" 119kJ/mol,可知:金刚石比石墨更稳定 |
| C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| D.没有单质参加的化合反应可能为氧化还原反应,也可能为放热反应 |
下列说法正确的是( )
| A.物质的化学变化都伴随着能量变化 |
| B.凡是吸热反应都需要加热 |
| C.任何反应中的能量变化都表现为热量变化 |
| D.拆开旧化学键吸收的能量一定大于形成新化学键放出的能量 |