题目内容
【题目】现有10种元素的性质、数据如下表所列,它们均为短周期元素.
A | B | C | D | E | F | G | H | I | J | |
原子半径 (10﹣10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
﹣2 | ﹣3 | ﹣1 | ﹣3 | ﹣2 |
回答下列问题:
(1)D在元素周期表中的位置_______,若H的一种同位素中子数为5,则其原子符号是_________,B元素的原子结构示意图是_________,G与F分别形成的简单离子半径大小关系为_________ 。
(2)F与A形成的化合物电子式是:_____________________。
(3)用电子式表示F2I的形成过程:_______________________________;
(4)F与J形成的化合物电子式为_____________,该化合物与水反应放出气体的化学方程式为__________________________。
【答案】 第三周期第VA族 ![]() B
B 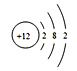 N3-> Na+
N3-> Na+ ![]() 、
、![]()
![]() Na+[:H]- NaH+H2O=NaOH+H2 ↑
Na+[:H]- NaH+H2O=NaOH+H2 ↑
【解析】试题分析:A元素主要化合价只有-2,所以A是O元素;C、F、J元素主要化合价只有+1,半径F>C>J,所以C是Li元素、F是Na元素、J是H元素;
D、G元素主要化合价只有+5、-3,半径D>G,所以D是P元素、G是N元素;I的主要化合价是+6、-2,I是S元素;E的主要化合价是+7、-1,E是Cl元素;B的主要化合价是+2,B是第ⅡA族元素,半径大于锂,所以B是第三周期,第ⅡA族元素,B是Mg元素;H的主要化合价是+3,H是第ⅢA族元素,半径小于磷,所以H是第二周期,第ⅢA族元素,H是B元素。
解析:根据以上分析,(1)D是P元素,在元素周期表中的位置第三周期第VA族,H是B元素,若H的一种同位素中子数为5,,质量数是10,则其原子符号是![]() B,B元素是Mg元素,原子结构示意图是
B,B元素是Mg元素,原子结构示意图是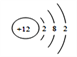 ,N3-与Na+电子层数相同,质子数N3-<Na+,离子半径大小关系为N3-> Na+ 。
,N3-与Na+电子层数相同,质子数N3-<Na+,离子半径大小关系为N3-> Na+ 。
(2)Na与O形成的化合物是过氧化钠和氧化钠,都是离子化合物,电子式是:![]() 、
、![]() 。
。
(3)Na2S是离子化合物,用电子式表示Na2S的形成过程:![]() ;
;
(4)Na与H形成的化合物是离子化合物,电子式为Na+[:H]- ,氢化钠与水反应放出氢气的化学方程式为NaH+H2O=NaOH+H2 ↑。