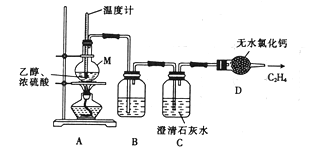
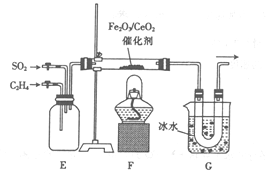
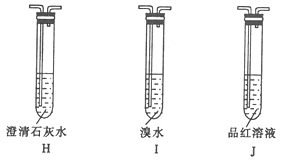
题目内容
【题目】常温下,等体积 、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是( )
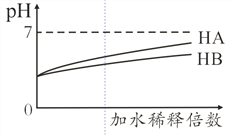
A. 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C. 氨水与HA溶液混合后的溶液中可能存在:c(NH4+)> c(A-)> c(H+) > c(OH-)
D. 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
【答案】D
【解析】由图可知,等体积 、pH均为3的HA和HB溶液分别加水稀释后,HA的pH变化大,HB的pH变化小,则酸性HA>HB。A.HB溶液电离出的氢离子抑制水的电离,滴加NaOH溶液的过程中,氢离子浓度逐渐减小,水的电离程度逐渐增大,完全反应后,氢氧化钠电离的氢氧根离子抑制水的电离,随后水的电离程度又逐渐减小,故A错误;B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,由于碱和HB的相对强弱未知,最终,溶液可能显碱性、酸性、中性,故B错误;C. 根据电荷守恒,氨水与HA溶液混合后的溶液中存在:c(NH4+) +c(H+) = c(A-)+ c(OH-),因此c(NH4+)> c(A-)> c(H+) > c(OH-)不可能成立,故C错误;D. 等体积等pH的HA、HB两溶液中HB的物质的量大于HA,完全中和时,消耗同浓度NaOH溶液的体积:HA<HB,故D正确;故选D。

【题目】现有10种元素的性质、数据如下表所列,它们均为短周期元素.
A | B | C | D | E | F | G | H | I | J | |
原子半径 (10﹣10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
﹣2 | ﹣3 | ﹣1 | ﹣3 | ﹣2 |
回答下列问题:
(1)D在元素周期表中的位置_______,若H的一种同位素中子数为5,则其原子符号是_________,B元素的原子结构示意图是_________,G与F分别形成的简单离子半径大小关系为_________ 。
(2)F与A形成的化合物电子式是:_____________________。
(3)用电子式表示F2I的形成过程:_______________________________;
(4)F与J形成的化合物电子式为_____________,该化合物与水反应放出气体的化学方程式为__________________________。