题目内容
 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:| 族 周期 |
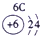
IA | 0 | 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2 | ② | ③ | ④ | 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)②、③、⑦元素的最高价含氧酸的酸性由强到弱的顺序是
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.MnO2b.FeCl3c.Na2SO3d.KMnO4
(4)元素⑥的氯化物溶液与稀氨水溶液反应的离子方程式
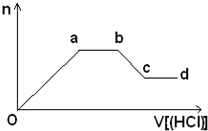
(5)某无色稀溶液X含有四种阴离子,是由②④⑥⑦⑧元素中的一种或两种组成.现取该溶液适量,向其中加入稀盐酸,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.则oa段转化为沉淀的离子(指来源于X溶液,下同)是
分析:由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl,
(1)同周期随原子序数增大,原子半径减小;
(2)同主族自上而下非金属性减弱,同周期自左而右非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强;
(3)表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,应是过氧化氢在二氧化锰或氯化铁作催化剂的条件下分解为水与氧气;
(4)Al3+与NH3?H2O反应得到Al(OH)3沉淀与NH4+;工业上电解熔融的氧化铝冶炼Al,反应生成Al与氧气;
(5)由图可知,溶液中加入HCl,会生成沉淀,且沉淀部分溶于HCl、部分不溶于盐酸,可推知溶液中一定含有SiO32-、AlO2-,ab段消耗盐酸,沉淀的最大量不变,说明溶液中还含有CO32-,还含有的阴离子为Cl-,据此解答.
(1)同周期随原子序数增大,原子半径减小;
(2)同主族自上而下非金属性减弱,同周期自左而右非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强;
(3)表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,应是过氧化氢在二氧化锰或氯化铁作催化剂的条件下分解为水与氧气;
(4)Al3+与NH3?H2O反应得到Al(OH)3沉淀与NH4+;工业上电解熔融的氧化铝冶炼Al,反应生成Al与氧气;
(5)由图可知,溶液中加入HCl,会生成沉淀,且沉淀部分溶于HCl、部分不溶于盐酸,可推知溶液中一定含有SiO32-、AlO2-,ab段消耗盐酸,沉淀的最大量不变,说明溶液中还含有CO32-,还含有的阴离子为Cl-,据此解答.
解答:解:由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl,
(1)同周期随原子序数增大,原子半径减小,故原子半径Na>Al>Si,
故答案为:Na>Al>Si;
(2)同主族自上而下非金属性减弱,同周期自左而右非金属性增强,故非金属性N>C>Si,非金属性越强,最高价氧化物对应水化物的酸性越强,则酸性HNO3>H2CO3>H2SiO3,
故答案为:HNO3>H2CO3>H2SiO3;
(3)表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,应是过氧化氢在二氧化锰或氯化铁作催化剂的条件下分解为水与氧气,
故答案为:ab;
(4)Al3+与NH3?H2O反应得到Al(OH)3沉淀与NH4+,离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,工业上电解熔融的氧化铝冶炼Al,还生成氧气,反应方程式为:2Al2O3(熔融)
4Al+3O2↑,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al2O3(熔融)
4Al+3O2↑;
(5)由图可知,溶液中加入HCl,会生成沉淀,且沉淀部分溶于HCl、部分不溶于盐酸,可推知溶液中一定含有SiO32-、AlO2-,ab段消耗盐酸,沉淀的最大量不变,说明溶液中还含有CO32-,还含有的阴离子为Cl-,则oa段转化为沉淀的离子是SiO32-、AlO2-;ab段发生反应的离子是CO32-,bc段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:SiO32-、AlO2-;CO32-;Al(OH)3+3H+=Al3++3H2O.
(1)同周期随原子序数增大,原子半径减小,故原子半径Na>Al>Si,
故答案为:Na>Al>Si;
(2)同主族自上而下非金属性减弱,同周期自左而右非金属性增强,故非金属性N>C>Si,非金属性越强,最高价氧化物对应水化物的酸性越强,则酸性HNO3>H2CO3>H2SiO3,
故答案为:HNO3>H2CO3>H2SiO3;
(3)表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,应是过氧化氢在二氧化锰或氯化铁作催化剂的条件下分解为水与氧气,
故答案为:ab;
(4)Al3+与NH3?H2O反应得到Al(OH)3沉淀与NH4+,离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,工业上电解熔融的氧化铝冶炼Al,还生成氧气,反应方程式为:2Al2O3(熔融)
| ||
| 冰晶石 |
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al2O3(熔融)
| ||
| 冰晶石 |
(5)由图可知,溶液中加入HCl,会生成沉淀,且沉淀部分溶于HCl、部分不溶于盐酸,可推知溶液中一定含有SiO32-、AlO2-,ab段消耗盐酸,沉淀的最大量不变,说明溶液中还含有CO32-,还含有的阴离子为Cl-,则oa段转化为沉淀的离子是SiO32-、AlO2-;ab段发生反应的离子是CO32-,bc段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:SiO32-、AlO2-;CO32-;Al(OH)3+3H+=Al3++3H2O.
点评:本题考查元素周期表、元素周期律、离子推断、常用化学用语等,题目难度中等,(5)中以图象形式考查离子反应,增大难度,需要学生分析沉淀变化推断离子,较好的考查学生综合能力与对基础知识的掌握.

练习册系列答案
相关题目









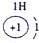
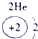
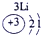
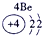
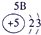
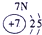
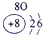
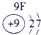
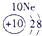
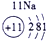





 表示的是
表示的是