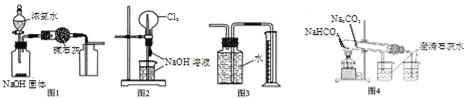题目内容
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用如图所示的装置制备NCl3,并探究NCl3的漂白性。NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40 ℃,沸点为 71 ℃,不溶于冷水,易溶于有机溶剂,密度为 1.65 g·mL-1 | Cl2与NH4Cl水溶液在低温下反应 | 95 ℃ 爆炸,热水中发生水解 |

回答下列问题:
(1)根据实验目的,接口连接的顺序为1-________-________-2-3-6-7-________-________-____。
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为____________________。
(3)A装置中发生反应的离子方程式为_________________________________________。
(4)B装置中发生反应的化学方程式为___________________________________,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 __________________。
(5)当E装置的锥形瓶内有黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,不褪色;若取该液体滴入热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,先变蓝后褪色,结合反应方程式解释该现象: _____________________________________________________________。
【答案】451098NaOH溶液MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O3Cl2+NH4Cl===NCl3+4HCl71~95 ℃NCl3+3H2O
Mn2++Cl2↑+2H2O3Cl2+NH4Cl===NCl3+4HCl71~95 ℃NCl3+3H2O![]() 3HClO+NH3,NCl3本身无漂白性;NCl3在热水中水解生成的NH3·H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色
3HClO+NH3,NCl3本身无漂白性;NCl3在热水中水解生成的NH3·H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色
【解析】
(1)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,加热蒸馏,再冷凝收集NCl3,最后用氢氧化钠溶液吸收尾气,防止污染空气,据此排序;
(2)氯气、氯化氢都能引起空气污染,不能直接排放,应进行尾气处理,根据氯气、氯化氢性质选择合适的除杂剂;
(3)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(4) B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,还生成HCl,反应方程式为:3Cl2+NH4Cl===NCl3+4HCl;加热蒸馏出NCl3,NCl3的沸点为71℃,在95℃爆炸,可以知道控制蒸馏温度范围;
(5) NCl3本身无漂白性,与水反应生成次氯酸和氨气,氨气与水反应生成一水合氨,一水合氨电离出氢氧根离子,溶液显碱性,使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色,据此解答。
(1) A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,加热蒸馏,再冷凝收集NCl3,最后用氢氧化钠溶液吸收尾气,防止污染空气,故仪器接口连接的顺序为:1、4、5、2、3、6、7、10、9、8,
因此,本题正确答案是:4 ;5 ; 10; 9; 8;
(2)C装置中盛放饱和食盐水,吸收除去HCl,E装置中盛放氢氧化钠溶液,吸收氯气,防止污染空气,
因此,本题正确答案是:NaOH溶液;
(3)A装置中利用二氧化锰与浓盐酸在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,
因此,本题正确答案是:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4) B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,还生成HCl,反应方程式为:3Cl2+NH4Cl===NCl3+4HCl;加热蒸馏出NCl3,NCl3的沸点为71℃,在95℃爆炸,可以知道控制蒸馏温度为71~95 ℃,
因此,本题正确答案是:3Cl2+NH4Cl===NCl3+4HCl ;71~95 ℃;
(5) E装置的锥形瓶内有黄色油状液体为NCl3,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,不褪色,说明NCl3没有漂白性,若取该液体滴入热水中,NCl3发生水解,片刻后取该热水再滴到干燥的红色石蕊试纸上,先变蓝后褪色,说明有碱性物质与强氧化性物质生成,水解应生成氨气与HClO。即发生反应为:NCl3+3H2O![]() 3HClO+NH3,
3HClO+NH3,
因此,本题正确答案是:NCl3+3H2O![]() 3HClO+NH3,NCl3本身无漂白性;NCl3在热水中水解生成的NH3·H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色。
3HClO+NH3,NCl3本身无漂白性;NCl3在热水中水解生成的NH3·H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】元素周期表中第三周期包括Na、Mg、Al、Si、P、S、Cl、Ar 8种元素。请回答下列问题:
(1)基态磷原子核外有________种运动状态不同的电子。
(2)第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“1”代表Ar)如下所示,则其中“2”原子的结构示意图为________,“8”单质晶体的类型为________。


(3)氢化镁
储氢材料的晶胞结构如图所示,已知该晶体的密度为ρ g·cm-3,则该晶体的化学式为________,晶胞的体积为________cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3 401 |
则KCl、MgO、CaO三种晶体的熔点从高到低的顺序是________________。其中MgO晶体中一个Mg2+周围和它最近且等距离的Mg2+有________个。
(5)Si、C和O的成键情况如下:
化学键 | C-O | C=O | Si-O | Si=O |
键能/(kJ·mol-1) | 360 | 803 | 464 | 640 |
C和O之间易形成含有双键的CO2分子晶体,而Si和O之间则易形成含有单键的SiO2原子晶体,请结合数据分析其原因:__________________________________________。