题目内容
【题目】在一定条件下发生反应:2A(g)+2B(g) ![]() xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.2molC,又测得反应速率VD=0.2mol/(L·min),下列说法正确的是( )
xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.2molC,又测得反应速率VD=0.2mol/(L·min),下列说法正确的是( )
A.A和B的转化率均是20%B.x = 3
C.平衡时A的物质的量为2.8molD.平衡时气体压强比原来减小
【答案】B
【解析】
根据反应速率之比等于化学计量数之比来确定化学计量数x,VD=0.2mol/(Lmin),VC= =0.3mol/(Lmin),则x=3;
=0.3mol/(Lmin),则x=3;
2A(g)+2B(g)![]() 3C(g)+2D(g)
3C(g)+2D(g)
开始(mol) 4 2 0 0
转化(mol) 0.8 0.8 1.2 0.8
平衡(mol) 3.2 1.2 1.2 0.8
结合转化率的概念及物质的量之比等于压强之比来计算。
A、由上述分析可知,A的转化率为![]() ×100%=20%,B的转化率为
×100%=20%,B的转化率为![]() ×100%=40%,故A错误;
×100%=40%,故A错误;
B、由上述分析可知,x=3,故B正确;
C、平衡时A的物质的量为3.2mol,故C错误;
D.同温同容条件下,容器内压强与气体物质的量成正比,该反应正向为气体体积增大的反应,则反应后压强增大,故D错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
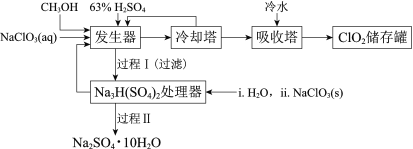
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
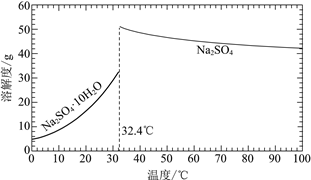
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。