题目内容
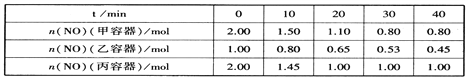
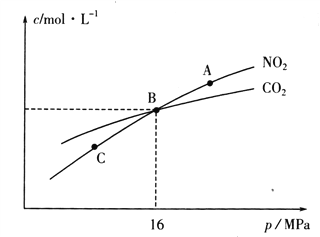
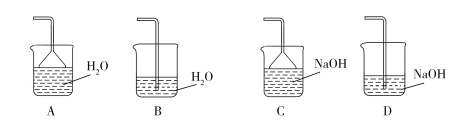
【题目】甲、乙两烧杯中各盛有100mL1.5mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入2.7g的铝粉,计算反应结束后生成的气体的体积比是( )
A.1:1B.1:2C.2:1D.3:2
【答案】B
【解析】
甲、乙两烧杯中各盛有100mL1.5molL1的盐酸和氢氧化钠溶液,可知HCl和NaOH的物质的量均为1.5molL1×0.1L=0.15mol,加入的Al粉质量为2.7g,其物质的量为![]() =0.1mol,再结合2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑分析,甲、乙烧杯中生成的氢气的物质的量,再推断体积比即可。
=0.1mol,再结合2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑分析,甲、乙烧杯中生成的氢气的物质的量,再推断体积比即可。
甲、乙两烧杯中各盛有100mL1.5molL1的盐酸和氢氧化钠溶液,可知HCl和NaOH的物质的量均为1.5molL1×0.1L=0.15mol,加入的Al粉质量为2.7g,其物质的量为![]() =0.1mol,在甲烧杯2Al+6HCl═2AlCl3+3H2↑中Al粉过量,生成氢气的物质的量为0.15mol×
=0.1mol,在甲烧杯2Al+6HCl═2AlCl3+3H2↑中Al粉过量,生成氢气的物质的量为0.15mol×![]() =0.075mol,在乙烧杯2Al+2NaOH+2H2O═2NaAlO2+3H2↑中,NaOH过量,生成氢气的物质的量为0.1mol×
=0.075mol,在乙烧杯2Al+2NaOH+2H2O═2NaAlO2+3H2↑中,NaOH过量,生成氢气的物质的量为0.1mol×![]() =0.15mol,则甲、乙两烧杯中生成气体在相同条件下的体积比等于气体的物质的量之比,即为0.075mol:0.15mol=1:2,答案选B。
=0.15mol,则甲、乙两烧杯中生成气体在相同条件下的体积比等于气体的物质的量之比,即为0.075mol:0.15mol=1:2,答案选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目