题目内容
17.NA表示阿伏加德罗常数的数值,下列叙述正确的是( )| A. | 等物质的量的N2和CO所含分子数均为NA | |
| B. | 1.7gH2O2中含有的电子数为0.9NA | |
| C. | NA个H2SO4分子的质量与H3PO4的摩尔质量相等 | |
| D. | 标准状况下,2.24L水所含分子数为0.1NA |
分析 A.气体物质的量相同,分子数相同;
B.1个双氧水分子含有18个电子;
C.质量与摩尔质量不是同一个物理量,无法比较;
D.气体摩尔体积使用对象为气体.
解答 解:A.等物质的量的N2和CO所含分子数,但是不一定是1mol,所以所含分子数不一定为NA,故A错误;
B.1.7gH2O2的物质的量为$\frac{1.7g}{34g/mol}$=0.05mol,含有的电子数为0.05mol×NA×18=0.9NA,故B正确;
C.NA个H2SO4分子的质量与H3PO4的摩尔质量,数值上相等,故C错误;
D.标况下,水是液态,不能使用气体摩尔体积,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积的使用条件和对象,注意物质的组成和结构,题目难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
5.二氧化硫与氧气的反应为:2SO2(g)+O2(g)?2SO3(g);△H<0,如对此反应升温,V正V逆变化正确的是( )
| A. | V正减小,V逆增大 | B. | V正增大,V逆减小 | C. | V正V逆都增大 | D. | V正V逆都减小 |
2.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 1mol•L-1Na2SO4溶液中Na+个数为2NA | |
| B. | 18g水含有电子数为10NA | |
| C. | 标准状况下,22.4LH2约含有2NA个H | |
| D. | 11.2LH2一定含有NA个H |
9.下列实验中,所选装置不合理的是( )
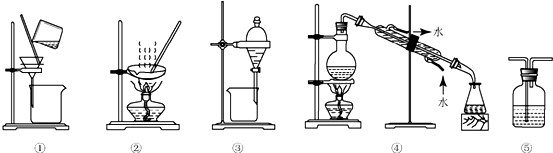

| A. | 分离花生油和NaCl溶液混合液,选④ | B. | 用CC14提取碘水中的碘,选③ | ||
| C. | 用NaOH溶液吸收CO中混有的CO2选⑤ | D. | 粗盐提纯,选①和② |
6.下列叙述中正确的是( )
| A. | 能电离出氢离子的化合物叫做酸 | |
| B. | 能电离出氢氧根离子的化合物叫做碱 | |
| C. | 盐电离出的阳离子只能是金属阳离子 | |
| D. | 由金属离子和酸根离子组成的化合物属于盐 |
7.下列化学用语中正确的是( )
| A. | CH4分子的比例模型: | B. | 羟基的电子式: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 乙醇的分子式:CH3CH2OH |
 4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变
4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变 化关系如图.下列说法正确的是( )
化关系如图.下列说法正确的是( )