题目内容
【题目】已知固体Na2SO3受热易分解,实验流程和结果如下:
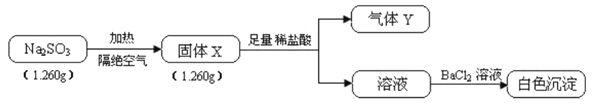
气体Y是一种纯净物,在标准状况下的密度为1.518g·L-1、请回答:
(1)气体Y分子的电子式___,白色沉淀的化学式_______。
(2)该流程中的Na2SO3受热分解的化学方程式__________。
(3)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式____________(不考虑空气的影响)。
【答案】 ![]() BaSO4 4Na2SO3
BaSO4 4Na2SO3![]() Na2S+3Na2SO4 SO32-+2S2-+6H+=3H2O+3S↓
Na2S+3Na2SO4 SO32-+2S2-+6H+=3H2O+3S↓
【解析】气体Y是一种纯净物,在标准状况下的密度为1.518g·L-1,Y的相对分子质量为1.518×22.4=34,结合Na2SO3中的元素可知,Y为H2S,固体X与盐酸反应生成硫化氢和溶液,溶液中加入氯化钡反应生成白色沉淀,说明固体X中含有Na2S和硫酸钠。
(1)气体Y为硫化氢,电子式为![]() ,白色沉淀为硫酸钡,故答案为:
,白色沉淀为硫酸钡,故答案为:![]() ;BaSO4;
;BaSO4;
(2)隔绝上述分析,流程中的Na2SO3受热分解的化学方程式为4Na2SO3![]() Na2S+3Na2SO4,故答案为:4Na2SO3
Na2S+3Na2SO4,故答案为:4Na2SO3![]() Na2S+3Na2SO4;
Na2S+3Na2SO4;
(3)固体X和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色硫沉淀产生,产生淡黄色沉淀的离子方程式为SO32-+2S2-+6H+=3H2O+3S↓,故答案为:SO32-+2S2-+6H+=3H2O+3S↓。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目


