题目内容
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
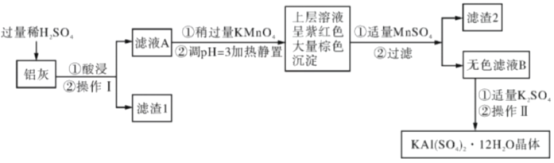
(1)明矾净水的原理是____________(用离子方程式表示)。
(2)操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥,
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):________
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:_________________,滤渣2含有的物质是_______________。
【答案】Al3++3H2O![]() Al(OH)3(胶体)+3H+ 冷却结晶 洗涤 酸性高锰酸钾溶液(或铁氰化钾溶液) 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 3Mn2++2MnO4-+2H2O=5MnO2↓+4H+ MnO2、Fe(OH)3
Al(OH)3(胶体)+3H+ 冷却结晶 洗涤 酸性高锰酸钾溶液(或铁氰化钾溶液) 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 3Mn2++2MnO4-+2H2O=5MnO2↓+4H+ MnO2、Fe(OH)3
【解析】
(1)明矾净水的原理主要是铝离子水解生成氢氧化铝胶体。
(2)操作Ⅱ从溶液到晶体的过程是蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是用酸性高锰酸钾,溶液褪色。
(4)将铝灰投入氢氧化钠溶液中生成气体,主要是铝和氢氧化钠反应生成偏铝酸钠和氢气,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,在滤液A中加入高锰酸钾发生反应生成锰离子和铁离子,其离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
(5)加入MnSO4发生反应主要是锰离子和高锰酸根离子反应生成二氧化锰,再根据氧化还原反应得到其离子方程式为3Mn2++2MnO4-+2H2O=5MnO2↓+4H+,滤渣2含有的物质是亚铁离子被氧化成铁离子而变为氢氧化铁,还有反应生成的二氧化锰。
(1)明矾净水的原理主要是铝离子水解生成氢氧化铝胶体,Al3++3H2O![]() Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O
Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。
(2)操作Ⅱ从溶液到晶体的过程是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶;洗涤。
(3)检验滤液A中是否存在Fe2+的试剂是用酸性高锰酸钾,溶液褪色,故答案为:酸性高锰酸钾溶液(或铁氰化钾溶液)。
(4)将铝灰投入氢氧化钠溶液中生成气体,主要是铝和氢氧化钠反应生成偏铝酸钠和氢气,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,在滤液A中加入高锰酸钾发生反应生成锰离子和铁离子,其离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
(5)加入MnSO4发生反应主要是锰离子和高锰酸根离子反应生成二氧化锰,再根据氧化还原反应得到其离子方程式为3Mn2++2MnO4-+2H2O=5MnO2↓+4H+,滤渣2含有的物质是亚铁离子被氧化成铁离子而变为氢氧化铁,还有反应生成的二氧化锰,故答案为:MnO2、Fe(OH)3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案