题目内容
【题目】25℃时拟用0.10mol/L的氢氧化钠溶液滴定10mL浓度为0.10mol/L醋酸的滴定曲线如图所示。横坐标为加入氢氧化钠的体积,纵坐标为溶液的pH。回答下列问题:
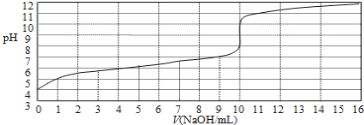
(1)该醋酸溶液的电离度α=______________。
(2)写出pH=7时溶液中离子浓度的大小关系:__________________________ 。
(3)为了准确指示终点本次滴定最好选用________做指示剂。
(4)写出滴入5mL氢氧化钠溶液时,溶液中的物料守恒关系:____________。
【答案】0.1% c(Na+)=c(CH3COO-)>c(H+)=c(OH-) 酚酞 2c(Na+)= c(CH3COOH)+ c(CH3COO-)
【解析】
由图可知,当NaOH的V=0mL时,0.10mol/L醋酸溶液的pH=4;当NaOH的V=10mL时,滴定曲线发生突变,说明达到了滴定终点;当NaOH的V=5mL时,醋酸反应一半,溶液中溶质为等物质的量的醋酸和醋酸钠,结合溶液中的三个守恒式分析解答。
(1)由图像可知,当NaOH的V=0mL时,0.10mol/L醋酸溶液的pH=4,可以认为醋酸电离出的c(H+)=110-4mol/L,醋酸的电离度为![]() =0.1%;
=0.1%;
(2)pH=7时溶液呈中性,根据电荷守恒,各离子的浓度大小关系为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(3)当恰好中和时溶质是醋酸钠,属于强碱弱酸盐,水解显碱性,应选酚酞做指示剂;
(4)当NaOH的V=10mL时,滴定曲线发生突变,说明达到了滴定终点,则当NaOH的V=5mL时,醋酸反应一半,溶液中溶质为等物质的量的醋酸和醋酸钠,物料守恒关系为:2c(Na+)= c(CH3COOH)+ c(CH3COO-)。

【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D