��Ŀ����
��15�֣�̫���ܵ�������ù��ЧӦʵ�������仯��һ������װ�ã�Ŀǰ����õ�����Ͷྦྷ����Ϊ�������ϡ��ߴ��ȵľ�����ͨ�����·�Ӧ��ã�
��Ӧ�٣��ϳ�¯����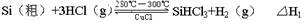
��Ӧ�ڣ���ԭ¯����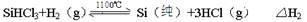
�й����ʵķе����±���ʾ��
| ���� | BCl3 | PCl3 | SiCl4 | AsCl3 | AlCl3 | SiHCl3 |
| �е� | 12��1 | 73��5 | 57��0 | 129��4 | 180�������� | 31��2 |
��1��̫���ܵ�ص�����ת����ʽΪ ���ɺϳ�¯�еõ���SiHCl3�����������ס��顢�����Ȼ������ʣ������SiHCl3�ķ����� ��
��2���������෴Ӧ����ij���(B)��ƽ��ѹǿ(PB)�������ʵ���Ũ��(cB)Ҳ�ɱ�ʾƽ�ⳣ��������KP������Ӧ�ٵ�KP�� ��
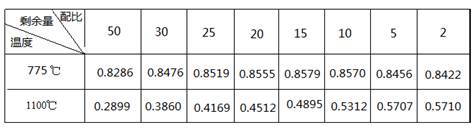
��3�����ڷ�Ӧ�ڣ���0��1Mpa�£���ͬ�¶Ⱥ�������ȣ�H2/SiHCl3����SiHCl3ʣ������Ӱ�����±���ʾ��
�ٸ÷�Ӧ�ġ�H2 0���>������<������=����
�ڰ��������5:1Ͷ�뻹ԭ¯�У���Ӧ��4minʱ���HCl��Ũ��Ϊ0��12mol��L��1����SiHCl3�����ʱ���ڵķ�Ӧ����Ϊ ��
�۶��ϱ������ݽ��з��������¶ȡ���ȶ�ʣ������Ӱ���У���ԭ¯�еķ�Ӧ�¶�ѡ����1100�棬����ѡ��775�棬���е�һ��ԭ��������ͬ����£��¶ȶ�SiHCl3 ʣ������Ӱ�죬�������һԭ���� ��
��4�����ڷ�Ӧ�ڣ���1100���£���ͬѹǿ��������ȣ�H2/SiHCl3����SiHCl3ʣ������Ӱ����ͼ27��1��ʾ��
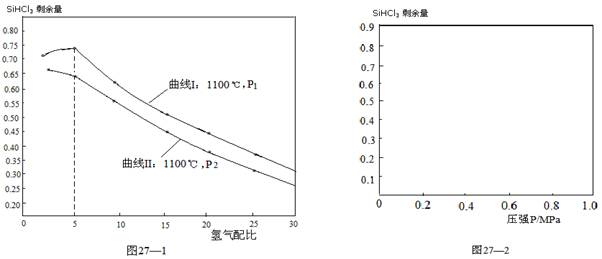
�� ͼ��P1 P2���>������<������=����
����ͼ27��2�л������������ͬ����£�1200���1100����¶��£�ϵͳ��SiHCl3ʣ������ѹǿ�仯�������仯����ʾ��ͼ��
��1��̫����ת��Ϊ���ܣ�1�֣� ����1�֣� ��2��Kp= PH2��PSiHCl3/P3HCl����2�֣�
(3) ��>��2�֣�
��0��01mol��L-1��min-1 ��2�֣�
����1100��ʱ��������ȶ�SiHCl3ʣ����Ӱ�����ԣ�����775�� ʱ��������ȶ�SiHCl3��ʣ����Ӱ�첻���ԣ�2�֣�
��4�� �� > ��2�֣� ����ͼ��3�֣�
���������������1��̫���ܵ�ص�����ת����ʽΪ̫����ת��Ϊ���ܣ����ݱ������ݿ�֪SiHCl3�ķе�ϵͣ��ɲ�������ķ�ʽ�ᴿ����2���������ʵ���Ũ��ƽ�ⳣ������ʽǨ�Ƶõ�ѹǿƽ�ⳣ����ѹǿƽ�ⳣ��Ϊ�����������ѹ��ϵ�����ݵij˻��뷴Ӧ�������ѹϵ�����ݳ˻��ı�ֵ����Ӧ�ٵ�KP��PH2��PSiHCl3/P3HCl����3���ٷ����������֪����SiHCl3�����������ͬʱ��775��ʱ��SiHCl3ʣ��������1100��ʱ��SiHCl3ʣ��������֪�¶����ߣ�ƽ�����淴Ӧ�����ƶ�������Ӧ�������ȣ�����H2��0���ڷ�Ӧ��4minʱ���HCl��Ũ��Ϊ0.12mol?L-1����v��HCl��=0.03mol��L-1��min-1�����û�ѧ������֮�ȵ��ڷ�Ӧ����֮�ȣ�v��SiHCl3��=1/3��0.03mol��L-1��min-1=0.01mol��L-1��min-1���۷����������֪�����������ͬʱ����1100��ʱ��������ȶ�SiHCl3ʣ����Ӱ�����ԣ�����775��ʱ��������ȶ�SiHCl3��ʣ����Ӱ�첻���ԣ���4���ٱȽϷ�Ӧ��ǰ�����������С������ѹǿ��SiHCl3ʣ�������۲�ͼ���֪P1���������ϲ࣬��P1ѹǿ��SiHCl3ʣ������P1��P2���ڷ�Ӧ�ڣ�����Ӧ���������������ѹǿ������SiHCl3ʣ������������Ӧ�������ȣ��¶�������SiHCl3ʣ�������ݴ˻���ͼ����𰸡�
���㣺���黯ѧ��Ӧ���ʺͻ�ѧƽ�⡣

 ��У����ϵ�д�
��У����ϵ�д�ʵ������ͭ��ϡ������ȡNOʱ��Ϊ�ӿ췴Ӧ���ʿɲ�ȡ�Ĵ�ʩ��
| A������ͭ������ | B������ѹǿ |
| C�������������� | D�����������Ũ�� |
��9�֣�����������������OH-�����·���ˮ�ⷴӦ��O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH.���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L,15 ��ʱ��ã�O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺
O2NC6H4COO-+C2H5OH.���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L,15 ��ʱ��ã�O2NC6H4COOC2H5��ת���ʦ���ʱ��仯�����������ʾ���ش��������⣺
| t/s | 0 | 120 | 180 | 240 | 330 | 30 | 600 | 700 | 800 |
| ��/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
��2����ʽ����15 ��ʱ�÷�Ӧ��ƽ�ⳣ��_________________��
��3��Ϊ���O2NC6H4COOC2H5��ƽ��ת���ʣ������ʵ����Ʒ�Ӧ�¶��⣬�����Բ�ȡ�Ĵ�ʩ��_________��Ҫ��д����������
��15�֣���֪��ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ���������������ԭ������ش��������⣺
��1�����淴ӦFeO��s����CO��g�� Fe��s����CO2��g����������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
Fe��s����CO2��g����������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
| T��K�� | 938 | 1100 |
| K | 0.68 | 0.40 |
��д���÷�Ӧƽ�ⳣ���ı���ʽ__________��
�����÷�Ӧ������̶����ܱ������н��У���һ�������´ﵽƽ��״̬���������¶ȣ���������ƽ����Է�������_____�����뺤�������������ܶ�____��ѡ���������С���������䡱����
��2�������£�Ũ�Ⱦ�Ϊ0.1 mol��L��1������������Һ��pH���±���
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
�ڸ��ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01 mol��L��1�������������ʵ���Һ�У�������ǿ���� ��
������Һ�ֱ�ϡ��100����pH�仯��С���� �����ţ���
A��HCN B��HClO C��C6H5OH D��CH3COOH E��H2CO3
�۾��ϱ����ݣ������ж����з�Ӧ���ܳ������� �����ţ���
A��CH3COOH�� Na2CO3��NaHCO3��CH3COONa B��CH3COOH��NaCN��CH3COONa��HCN
C��CO2��H2O��2NaClO��Na2CO3��2HClO D��CO2��H2O��2C6H5ONa��Na2CO3��2C6H5OH
��Ҫ������ˮ��HClO��Ũ�ȣ�������ˮ�м���������̼������Һ����Ӧ�����ӷ���ʽΪ
��3����֪������Cu��OH��2��Ksp��2��10��20����֪������ijCuSO4��Һ��c��Cu2������0.02 mol��L��1�����Ҫ����Cu��OH��2��������Ӧ������ҺpH���� ��Ҫʹ0.2 mol��L��1��CuSO4��Һ��Cu2��������Ϊ��ȫ �� ʹCu2��Ũ�Ƚ���ԭ��ǧ��֮һ����Ӧ����Һ���NaOH��Һ��ʹ��ҺpHΪ ��
 2SO3 ���ƽ��ʱ����������ʵ���Ϊ5mol����
2SO3 ���ƽ��ʱ����������ʵ���Ϊ5mol����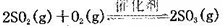 ������Ӧ���ȣ������n��O2����ʱ��ı仯���±�
������Ӧ���ȣ������n��O2����ʱ��ı仯���±�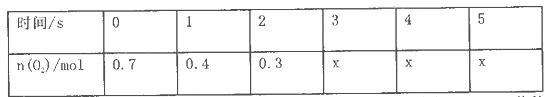
 H2+I2
H2+I2

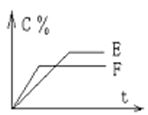
 pC(��) + qD(��)�� C %��ʱ�� t����ͼ��ϵ
pC(��) + qD(��)�� C %��ʱ�� t����ͼ��ϵ