题目内容
【题目】乙二胺(H2NCH2CH2NH2),无色液体,有类似氨的性质。已知:25℃时,Kb1=10-4.07Kb2=10-7.15;乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液pH的变化曲线如右图。下列说法错误的是

A. H2NCH2CH2NH2在水溶液中第一步电离的方程式为:H2NCH2CH2NH2+H2O![]() H2NCH2CH2NH3++OH-
H2NCH2CH2NH3++OH-
B. 曲线Ⅰ代表的微粒符号为[H3NCH2CH2NH3]2+
C. 曲线Ⅰ与曲线Ⅱ相交点对应pH=4.07
D. 在0.1mol·L-1 H2NCH2CH2NH3Cl溶液中各离子浓度大小关系为c(Cl-)>(H2NCH2CH2NH3+) >c(OH-)>c(H+)
【答案】C
【解析】A. 乙二胺(H2NCH2CH2NH2)有类似氨的性质,根据题目信息Kb1=10-4.07、Kb2=10-7.15可知,H2NCH2CH2NH2在水溶液中分两步电离,第一步电离的方程式为:H2NCH2CH2NH2+H2O![]() H2NCH2CH2NH3++OH-,故A正确;B. H2NCH2CH2NH2在水溶液中分两步电离,电离方程式分别为:H2NCH2CH2NH2+H2O
H2NCH2CH2NH3++OH-,故A正确;B. H2NCH2CH2NH2在水溶液中分两步电离,电离方程式分别为:H2NCH2CH2NH2+H2O![]() H2NCH2CH2NH3++OH-、H2NCH2CH2NH3++H2O
H2NCH2CH2NH3++OH-、H2NCH2CH2NH3++H2O![]() [H3NCH2CH2NH3]2++OH-,根据方程式可知,溶液pH越小,越有利于电离平衡正向移动,[H3NCH2CH2NH3]2+浓度越大,所以曲线Ⅰ代表的微粒符号为[H3NCH2CH2NH3]2+,故B正确;C. 曲线II代表的微粒符号为H2NCH2CH2NH3+,曲线Ⅰ与曲线Ⅱ相交点对应的溶液中,[H3NCH2CH2NH3]2+和H2NCH2CH2NH3+浓度相等,根据H2NCH2CH2NH3++H2O
[H3NCH2CH2NH3]2++OH-,根据方程式可知,溶液pH越小,越有利于电离平衡正向移动,[H3NCH2CH2NH3]2+浓度越大,所以曲线Ⅰ代表的微粒符号为[H3NCH2CH2NH3]2+,故B正确;C. 曲线II代表的微粒符号为H2NCH2CH2NH3+,曲线Ⅰ与曲线Ⅱ相交点对应的溶液中,[H3NCH2CH2NH3]2+和H2NCH2CH2NH3+浓度相等,根据H2NCH2CH2NH3++H2O![]() [H3NCH2CH2NH3]2++OH-可知,Kb2=10-7.15=
[H3NCH2CH2NH3]2++OH-可知,Kb2=10-7.15=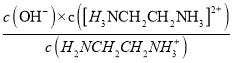 =c(OH-),则c(H+)=
=c(OH-),则c(H+)=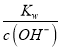 =10-6.85,pH=6.85,故C错误;D. 在0.1mol·L-1 H2NCH2CH2NH3Cl溶液中,因H2NCH2CH2NH3+水解使溶液呈酸性,则各离子浓度大小关系为c(Cl-)>(H2NCH2CH2NH3+)>c(OH-)>c(H+),故D正确;答案选C。
=10-6.85,pH=6.85,故C错误;D. 在0.1mol·L-1 H2NCH2CH2NH3Cl溶液中,因H2NCH2CH2NH3+水解使溶液呈酸性,则各离子浓度大小关系为c(Cl-)>(H2NCH2CH2NH3+)>c(OH-)>c(H+),故D正确;答案选C。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】充分利用碳的氧化物合成化工原料,既可以减少环境污染和温室效应,又能变废为宝。
Ⅰ.CO2的综合利用是解决温室效应及能源问题的有效途径。
(1)O2和H2在催化剂存在下可发生反应生成CH3OH。已知CH3OH、H2的燃烧热分别为△H1=-akJ·mol-1、△H2=-bkJ·mol-1,且1mol水蒸气转化为液态水时放出ckJ的热量。
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
(2)对于CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。
CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。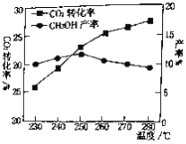
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
Ⅱ.CO是合成尿素、甲酸的原料。
(3)合成尿素的反应:2NH3(g)+CO(g)![]() CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
①T℃时,在体积为2L的恒容密闭容器中,将2molNH3和1molCO混合发生反应,5min时,NH3的转化率为80%。则0~5min内的平均反应速率为v(CO)=___________。
②已知:
温度/K | 398 | 498 | … |
平衡常数/K | 126.5 | K1 | … |
则:K1___________126.5(填“>”或“<”);其判断理由是___________。
(4)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1mol·L-1的HCOOH和HCOONa混合溶液pH=3.7,则HCOOH的电离常数Ka的值为___________ (已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。Co3+氧化HCOOH的离子方程式为___________;忽略体积变化,电解前后Co2+的浓度将___________ (填“增大”“减小”或“不变”)。
【题目】下列物质分类正确的是( )
A.Na2O,Na2O2 , FeO,Fe2O3都是碱性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.纯碱、烧碱、四氯化碳均为电解质
D.水玻璃、氯水、漂白粉均为混合物
【题目】氮气是制备含氮化合物的重要原料,而含氮化合物的用途广泛。回答下列问题:
(1)两个常见的固氮反应为:
N2(g)+O2(g)![]() 2NO(g)…………(Ⅰ)
2NO(g)…………(Ⅰ)
N2(g)+3H2(g)![]() 2NH3(g)…………(Ⅱ)
2NH3(g)…………(Ⅱ)
①气相反应中,某物质A 的组成习惯用分压p(A)代替浓度c(A),相应的平衡常数用Kp表示。反应(Ⅰ)的平衡常数表达式Kp=_________________。
②反应(Ⅱ)在不同温度下的平衡常数Kp如下表:
温度/K | 298 | 473 | 673 |
Kp | 62(KPa)-2 | 6.2×10-5(KPa)-2 | 6.0×10-8(KPa)-2 |
则反应(Ⅱ) 的ΔH________0(填“>”、“<”或“=”)
(2)合成氨工业中原料气所含的少量CO对合成塔中的催化剂有害,可由“铜洗”工序实现对原料气精制。有关反应的化学方程式如下:
[Cu(NH3)2]Ac(aq)+CO(g) +NH3(g)![]() [Cu(NH3)3] ]Ac·CO(aq)
[Cu(NH3)3] ]Ac·CO(aq)
ΔH=-35 kJ·mol-1,用化学平衡移动原理分析该工序生产的适宜条件为________________________。
(3)氨气是工业制硝酸的主要原料。T℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H= -907kJmol-1
4NO(g)+6H2O(g) △H= -907kJmol-1
②4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H= -1269kJmol-1
2N2(g)+6H2O(g) △H= -1269kJmol-1
其中②是副反应。若要减少副反应,提高NO的产率,最合理的措施是___________________;
T℃时N2和O2反应生成NO的热化学方程式为________________________________。
(4)生产和实验中常采用甲醛法测定铵盐的含氢量。反应原理如下:
4NH4++6HCHO==(CH2)6N4H+(一元酸)+3H++6H2O
实验步骤如下:
①取铵盐样品溶液a mL,加入稍过量的甲醛溶液(已除去其中的酸),静置1分钟;
②滴入1-2滴酚酞溶液,用cmol·L-1的氢氧化钠溶液滴定至溶液呈粉红色且半分钟内不褪去为止,记录消耗氢氧化钠溶液的体积;
③重复以上操作2 次,三次实验平均消耗氢氧化钠溶液VmL。
则样品中的含氮量为____mg·L-1;下列铵盐不适合用甲醛法测定含氮量的是____________(填标号)。
a.NH4HCO3 b. (NH4)2SO4 c.NH4Cl d.CH3COONH4





