题目内容
【题目】次磷酸(H3PO2)是一种具有强还原性的一元弱酸,工业上常利用H3PO2和AgNO3溶液反应进行化学镀银,已知该反应中氧化剂与还原剂的物质的量之比为4:1,则下列说法中不正确的是( )
A. H3PO2中磷元素的化合价为+1 B. H3PO2的电离方程式为H3PO2![]() H++H2PO2-
H++H2PO2-
C. H3PO2被AgNO3氧化成了H3PO4 D. NaH2PO2、NaH2PO4、Na2HPO4均为酸式盐
【答案】D
【解析】
A.H3PO2中H为+1价,O为-2价,则磷元素的化合价为+1,选项A正确;B.次磷酸是一元弱酸,一元弱酸部分电离出一个氢离子,所以H3PO2的电离方程式为H3PO2H++H2 PO2-,选项B正确;C.H3PO2中,氢元素为+1价,氧元素为-2价,依据化合价代数和为0,磷化合价为+1价,该反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4,选项C正确;D.H3PO2是一元酸,NaH2PO2是正盐,NaH2PO4、Na2HPO4均为酸式盐,选项D错误。答案选D。

【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
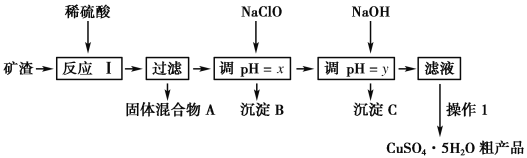
已知:①Cu2O+2H+===Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是____________ (写两条)。
(2)固体混合物A中的成分是________。
(3)反应Ⅰ完成后,铁元素的存在形式为________(填离子符号);写出生成该离子的离子方程式____________。
(4)操作1主要包括:蒸发浓缩、冷却结晶、________。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是______________。
(5)用NaCl0调pH可以生成沉淀B,利用题中所给信息分析沉淀B为_______,该反应的离子方程式为______________.


