题目内容
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如图1实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体请回答:
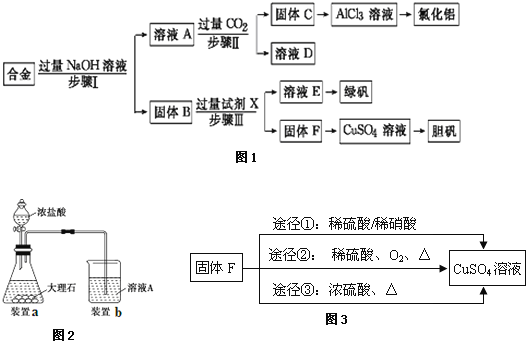
(1)写出步骤Ⅰ反应的离子方程式: ______ 。
(2)试剂X是 ______。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 ______。
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是 ______。
(4)由溶液E到绿矾晶体(FeSO47H2O),所需操作是 ______ 、 ______ 、 ______ 、洗涤、干燥。
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:写出途径①中反应的离子方程式 ______ ,请选出你认为的最佳途径并说明选择的理由 ______ 。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ 稀硫酸 过滤 在a、b之间添加盛放饱和NaHCO3溶液的洗气瓶 蒸发浓缩 冷却结晶 过滤 3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O 途径②最佳,理由是原料利用率高,环境污染小
【解析】
金属铁和金属铜不与氢氧化钠反应,铝可与氢氧化钠反应,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体流程为:合金中铝、氧化铝与氢氧化钠反应,所得滤液A为NaAlO2溶液,经途径Ⅱ与足量二氧化碳发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应可生成氢氧化铝固体C,生成的氢氧化铝再和盐酸反应生成AlCl3,得到的AlCl3较纯净;溶液D为碳酸氢钠溶液;
滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾,以此解答本题。
(1)步骤Ⅰ加过量的氢氧化钠,金属铝和氢氧化钠反应,金属铝溶解其中生成偏铝酸钠溶液,即2Al+2OH+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH+2H2O=2AlO2-+3H2↑;
(2)金属铁和金属铜不与氢氧化钠反应,金属铜和稀硫酸之间不反应,但是金属铁可以和稀硫酸之间反应生成硫酸亚铁和氢气,进而制的绿矾晶体,步骤Ⅰ、Ⅱ、Ⅲ均是固体和液体的分离操作,应该是过滤,
故答案为:稀硫酸;过滤;
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是二氧化碳气体中含有从盐酸中挥发出的氯化氢气体,氯化氢在水中溶解了部分沉淀氢氧化铝,发生的反应为Al(OH)3+3H+=Al3++3H2O,为了避免固体C减少,可在制取二氧化碳的收集装置中增加一个洗去氯化氢的装置,二氧化碳在饱和碳酸氢钠中不溶,氯化氢和碳酸氢钠反应生成二氧化碳气体,所以可在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶,除去二氧化碳中的氯化氢,
故答案为:在a、b之间添加盛放饱和NaHCO3溶液的洗气瓶;
(4)溶液E为FeSO4溶液,得到绿矾晶体(FeSO47H2O)的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩;冷却结晶;过滤;
(5)金属铜可以和稀硝酸之间反应生成硝酸铜、一氧化氮和水,即3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,不会产生污染大气的气体,该过程原料利用率高,且环境污染小,所以途径②最佳,
故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;途径②最佳,理由是原料利用率高,环境污染小。

 一本好题口算题卡系列答案
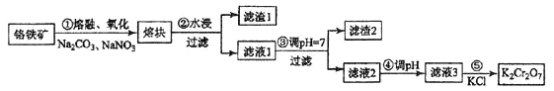
一本好题口算题卡系列答案【题目】某工厂对制革工业污泥中铬的处理工艺流程如下:
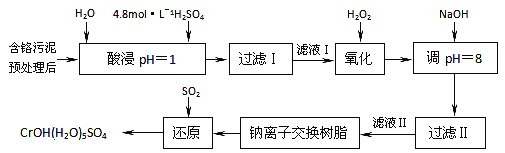
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_________、___________。(答出两点)。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是________________________________。
②常温下,当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度不超过1mol·L-1)___________ 。 (填“是”或“否”)若要使Mg2+完全沉淀,溶液的pH至少为_________(已知Ksp[Mg(OH)2]=1. 6×10-12,lg2=0.3)。