题目内容
19.如图1是实验室制SO2并验证SO2某些性质的装置图.试回答:
(1)写出②中的实验现象是紫色石蕊试液变红.
(2)③中的实验现象是品红褪色,证明SO2具有漂白性.
(3)证明SO2有还原性的实验是试剂瓶⑤(填试剂瓶的数字编号)中溶液颜色变浅.
(4)证明SO2有氧化性的实验的试剂瓶中发生的化学反应SO2+2H2S=3S↓+2H2O.
(5)该实验装置不完善在装置图的虚线框如图2中应当安装尾气吸收装置,原因是SO2能造成环境污染.
分析 由图中实验装置可知,①中发生Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,生成的二氧化硫为酸性氧化物,则②中石蕊变红,二氧化硫具有漂白性,则③中品红溶液褪色,④中发生SO2+2 H2S=3S↓+2H2O,观察到沉淀生成,⑤中二氧化硫与碘水发生氧化还原反应生成硫酸和HI,虚线框如图2中应当安装尾气吸收装置,因二氧化硫有毒,不能排放在环境中,以此来解答.
解答 解:(1)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸,可以使紫色石蕊试液变红,故答案为:紫色石蕊试液变红;
(2)二氧化硫与品红化合生成无色物质,能使品红溶液褪色,故二氧化硫具有漂白性,故答案为:漂白;
(3)①中制备二氧化硫,②体现酸性氧化物的性质,③体现其漂白性,④发生SO2+2H2S=3S↓+2H20体现二氧化硫的氧化性,⑤中发生I2+SO2+2H2O=2HI+H2SO4,显然只有⑤中S元素的化合价升高,体现其还原性,
故答案为:⑤;
(4)证明SO2有氧化性的实验的试剂瓶中发生的化学反应为SO2+2H2S=3S↓+2H2O,故答案为:SO2+2H2S=3S↓+2H2O;
(5)虚线框如图2中应当安装尾气吸收装置,原因是SO2能造成环境污染,故答案为:SO2能造成环境污染.
点评 本题考查了SO2的性质实验和制备实验,为高频考点,把握实验装置的作用、二氧化硫的性质、反应与现象的关系是解题关键,侧重分析与实验能力的考查,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
6.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外电子层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A. | W、Y、Z的电负性大小顺序一定是Z>Y>W | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | Y、Z形成的分子的空间构型可能是正四面体 | |
| D. | 若有WY2,则WY2分子中σ键与π键的数目之比是2:1 |
7.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
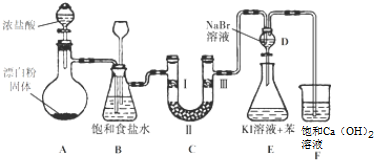
(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是分液漏斗,请写出该反应相应的离子方程式:ClO-+2H++Cl-=Cl2↑++H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是d(填字母编号).
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色,该现象不能(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是氯气具有强氧化性,过量的氯气能够将碘离子氧化成碘单质,离子方程式为:Cl2+2I-=I2+2Cl-(用必要的文字和离子方程式回答).
(5)此装置需要改进之处是:F原因是:氢氧化钙为微溶物,溶液中所含溶质较少,吸收氯气不充分,应改为氢氧化钠溶液吸收.

(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是分液漏斗,请写出该反应相应的离子方程式:ClO-+2H++Cl-=Cl2↑++H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是d(填字母编号).
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)此装置需要改进之处是:F原因是:氢氧化钙为微溶物,溶液中所含溶质较少,吸收氯气不充分,应改为氢氧化钠溶液吸收.
7.在298K时,2molH2燃烧生成水蒸汽放出484kJ热量,下列热化学方程式正确的是( )
| A. | 2H2+O2=2H2O,△H=-484kJ/mol | B. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ/mol | ||
| C. | 2H2(g)+O2(g)=2H2O(l),△H=-484kJ/mol | D. | H2(g)+O2(g)=H2O(g)△H=+242kJ/mol |
14.能证明碳酸的酸性比硅酸强的事实是( )
| A. | 二氧化碳溶于水生成碳酸,二氧化硅不溶于水也不能跟水直接反应生成硅酸 | |
| B. | 在高温条件下,二氧化硅跟碳酸钠反应,生成硅酸钠和二氧化碳 | |
| C. | 二氧化硅的熔点比二氧化碳高 | |
| D. | 二氧化碳通入Na2SiO3稀溶液中,生成白色胶状沉淀 |
4.室温时,pH=2的一元酸溶液与pH=12的NaOH溶液等体积混合,则溶液的pH值( )
| A. | 一定不大于7 | B. | 一定不小于7 | C. | 一定等于7 | D. | 可能大于7 |
8.下列化合物中,只有在水溶液中才能导电的电解质是( )
| A. | H2SO4 | B. | C2H5OH | C. | NaCl | D. | NaHCO3 |
9.将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+)>c(X-),则下列关系正确的是( )
| A. | c(OH-)<c(H+) | B. | c(HX)<c(X-) | ||
| C. | c(X-)+c(HX)=2c(Na+) | D. | c(HX)+c(H+)=c(Na+)+c(OH-) |