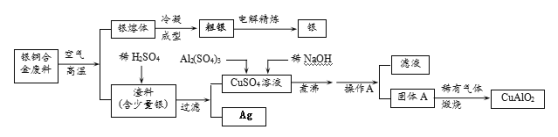
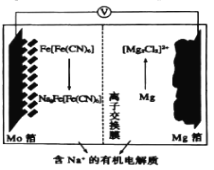
题目内容
【题目】在100℃时,容积为5L的真空密闭容器中加入一定量的N2O4,容器内N2O4和NO2的物质的量变化如下表所示:
时间/s | 0 | 2 | 10 | 30 | 60 | 90 |
n(N2O4)/mol | 0.3 | 0.25 | 0.15 | 0.125 | b | 0.12 |
n(NO2)/mol | 0 | 0.1 | a | 0.35 | 0.36 | 0.36 |
下列说法正确的是( )
A.10s时,以NO2浓度变化表示的该反应速率为0.006molL-1s-1
B.该温度下反应2(NO2g)N2O4(g)的平衡常数K=0.216
C.35s时容器内压强为反应前的1.6倍
D.其它条件不变,90s后向容器中再加入0.3molNO2建立新平衡时,与原平衡时比较,气体平均相对分子质量增大
【答案】D
【解析】
根据表格数据分析,60s时反应已经达到平衡,则b=0.12mol,根据反应N2O4(g) 2NO2(g),10s时,N2O4物质的量的变化量=0.3mol-0.15mol=0.15mol,变化的物质的量之比等于化学计量数之比,则a=0.3mol,据此分析解答。
A.10s内,以NO2浓度变化表示的该反应平均速率为0.006mol·L-1·s-1,10s时为瞬时速率,小于0.006mol·L-1·s-1,故A错误;
B.根据分析,60s时反应达到平衡,平衡时,N2O4为0.12mol,NO2为0.36mol,容积为5L,该温度下反应2NO2(g)N2O4(g)的平衡常数K=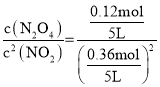 =4.63,故B错误;
=4.63,故B错误;
C.35s时若反应体系达到平衡状态,根据气体的物质的量之比等于压强之比,则![]() =1.6,但根据题中表格数据,35s时容器可能不一定平衡,压强不一定是反应前的1.6倍,故C错误;
=1.6,但根据题中表格数据,35s时容器可能不一定平衡,压强不一定是反应前的1.6倍,故C错误;
D.其它条件不变,90s后向容器中再加入0.3molNO2,因为容器体积不变,充入NO2或N2O4越多,N2O4的体积分数越大,建立新平衡时,与原平衡时比较,气体平均相对分子质量增大,故D正确;
答案选D。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】为测定镀锌铁皮锌镀层厚度[ρ(Zn)=7.14gcm-3],某兴趣小组同学截取三块形状规则、大小相近的长方形铁皮(来自同一块镀锌铁皮),量出其长度与宽度,计算得铁片单侧面积;用稀硫酸进行定量试验,数据如下:
实验序号 | 铁片单侧面积/cm2 | 反应前质量/g | 反应后质量/g |
1 | 25.05 | 14.625 | 13.803 |
2 | 24.95 | 14.566 | 13.746 |
3 | 24.89 | 14.489 | 12.789 |
该镀锌铁皮锌镀层厚度为___cm(保留2位有效数字);写出简要计算过程。