题目内容
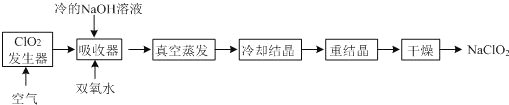
【题目】以Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法不正确的是( )

A.放电时,正极反应式:Fe[Fe(CN)6]+2Na++2e-=Na2Fe(Fe(CN)6]
B.充电时,Mg箔接电源的负极
C.充电时,Na+通过离子交换膜从左室移向右室
D.放电时,Mo箔增加4.6g时,Mg箔减少5.95g
【答案】D
【解析】
根据放电工作原理图,Mo作正极,在正极上发生还原反应:Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6],Mg作负极,负极上是失电子的氧化反应:2Mg+2Cl--4e-=[Mg2Cl2]2+,充电时,原电池的负极连接电源的负极,电极反应和放电时的相反,据此分析解答。
A.根据工作原理,Mg作负极,Mo作正极,放电时,正极反应式为:Fe[Fe(CN)6]+2Na++2e-=Na2Fe(Fe(CN)6],故A正确;
B.充电时,电池的负极接电源的负极,电池的正极接电源的正极,放电时Mg箔为负极,则充电时,Mg箔接电源的负极作为阴极,故B正确;
C.充电时,Na+通过交换膜移向阴极,即从左室移向右室,故C正确;
D.放电时,由Fe[Fe(CN)6]被还原为Na2Fe[Fe(CN)6],Mo箔增加4.6g时,根据电极反应Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6],增加的质量为Na的质量,即增加0.2mol的钠,转移0.2mol电子,根据电极反应:2Mg+2Cl--4e-=[Mg2Cl2]2+,转移0.2mol电子,消耗0.1mol的Mg,则Mg箔减少的质量为0.1mol×24g/mol=2.4g,故D错误;
答案选D。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】在100℃时,容积为5L的真空密闭容器中加入一定量的N2O4,容器内N2O4和NO2的物质的量变化如下表所示:
时间/s | 0 | 2 | 10 | 30 | 60 | 90 |
n(N2O4)/mol | 0.3 | 0.25 | 0.15 | 0.125 | b | 0.12 |
n(NO2)/mol | 0 | 0.1 | a | 0.35 | 0.36 | 0.36 |
下列说法正确的是( )
A.10s时,以NO2浓度变化表示的该反应速率为0.006molL-1s-1
B.该温度下反应2(NO2g)N2O4(g)的平衡常数K=0.216
C.35s时容器内压强为反应前的1.6倍
D.其它条件不变,90s后向容器中再加入0.3molNO2建立新平衡时,与原平衡时比较,气体平均相对分子质量增大