��Ŀ����
����Ŀ��Ī���Σ�(NH4)2Fe(SO4)26H2O��Mr��392����һ����Ҫ�Ļ�ԭ�����ڿ����б�һ����������ȶ���ijѧϰС���������ʵ���Ʊ�������Ī���β��ⶨ�䴿�ȡ�
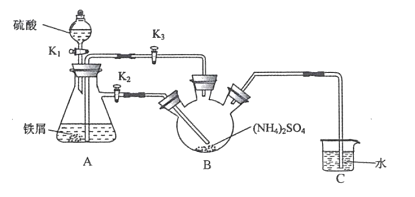
�ش��������⣺
����ȡĪ����
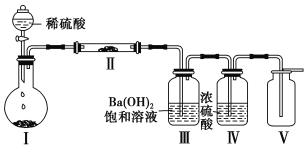
��1������װ�ã����װ�������ԡ���0.1mol��NH4��2SO4���������ڲ���������______�����������ƣ�����6.0g������м������ƿ�С�
��2���ٴ�Һ©��ƿ�����رջ���K3����K2��K1������55.0mL2mol��L-1ϡ�����ر�K1��Aװ���з�Ӧ�����ӷ���ʽΪ____
�ڴ��������ܽ��K3���ر�K2����ʱ���Կ���������Ϊ_______��ԭ����_______
�۹رջ���K2��K3������100��ˮԡ����B��ˮ�֣�Һ�������Ĥʱ��ֹͣ���ȣ���ȴ�ᾧ��____������ˮ�Ҵ�ϴ�Ӿ��塣�÷�Ӧ�������������������Һ��pH��1��2֮�䣬��Ŀ��Ϊ____
��װ��C������Ϊ ____��װ��C���ڵ�ȱ����____
�ⶨĪ������Ʒ�Ĵ���
��3����ȡ����Ī������Ʒ10.0g������к���ȴ������ˮ���100mL��Һ��ȡ20.00mL��Һ����ϡ���ᣬ��0.1molL-1��KMnO4��Һ�ζ����ﵽ�ζ��յ�ʱ����10.00mlKMnO4��Һ���ζ���Ӧ�����ӷ���ʽΪ____������Ʒ�Ĵ���Ϊ____
���𰸡�������ƿ������ƿ������ƿ��������ƿ�� Fe+2H+![]() H2��+Fe2+ A�е�Һ�屻ѹ��B�� A�в���������ʹA��ѹǿ���� ���� ����Fe2+ˮ�� Һ�����ã���ֹ��������������ƿ����Fe2+ ���ܳ�ȥβ���е�H2�����ܻᵹ������ 5Fe2++MnO4-+8H+
H2��+Fe2+ A�е�Һ�屻ѹ��B�� A�в���������ʹA��ѹǿ���� ���� ����Fe2+ˮ�� Һ�����ã���ֹ��������������ƿ����Fe2+ ���ܳ�ȥβ���е�H2�����ܻᵹ������ 5Fe2++MnO4-+8H+![]() 5Fe3++Mn2++4H2O 98%
5Fe3++Mn2++4H2O 98%
��������
����ȡĪ���Σ���Һ©��ƿ�����رջ���K3 ����K2��K1������55.0mL2mol��L-1ϡ���������Ӧ������������װ���ڵĿ����ϳ������������ܽ��K3���ر�K2��A�е�Һ�屻ѹ��B�У��رջ���K2��K3������100��ˮԡ����B��ˮ�֣�������Ī���Σ���ȴ�ᾧ�����ˣ�����ˮ�Ҵ�ϴ�ӣ���Ī���ξ��壬װ��C������Һ�⣬��ֹ��������������ƿ����Fe2����
�ⶨĪ������Ʒ�Ĵ��ȣ�����5Fe2��+MnO4��+8H���T5Fe3��+Mn2��+4H2O���ӷ���ʽ���㡣
��1����װ�ýṹ��֪��װ��Ϊ������ƿ��
��2�����������ᷴӦ�����������������������ӷ���ʽΪ��Fe+2H���TH2��+Fe2����
�ڴ��������ܽ��K3���ر�K2��A������������ѹǿ����A�е�Һ��ѹ��B�У���ʱ���Կ���������Ϊ��A�е�Һ�屻ѹ��B�У�ԭ���ǣ�A�в���������ʹA��ѹǿ����
�۲���100��ˮԡ����B��ˮ�֣�Һ�������Ĥʱ��ֹͣ���ȣ���ȴ�ᾧ��Ȼ���ù��˵ķ������������Һ�з�����������������������Һ��pH��1��2֮�䣬��Ŀ��Ϊ����Fe2�� ˮ�⣻
��װ��C�ĵ��ܲ���Һ�����£�����Һ�����ã�ǰ�ɷ�ֹ��������������ƿ��Fe2��������װ��C���ڵ�ȱ���ǣ����ܳ�ȥβ���е�H2��Ҳ���ܷ�ֹ������
��3��Fe2�����л�ԭ�ԣ��������ط�Ӧ5Fe2��+MnO4��+8H���T5Fe3��+Mn2��+4H2O��n��KMnO4��=0.01L��0.1mol��L��1=0.001mol����20.00mL��Һ��n��Fe2����=0.005mol��10.0g��Ʒ��n��Fe2����=0.005mol��100mL/20mL=0.025mol����10.0g��Ʒ�У�NH4��2Fe��SO4��2��6H2O�����ʵ���Ϊ0.025mol����Ʒ�ĺ���Ϊ0.025mol��392g��mol��1/10g��100%=98%��

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�