题目内容
【题目】氧化还原反应在日常生活和生产中应用广泛,结合相关知识回答下列问题:
I.根据反应①~③,回答下列问题:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3 ③2FeCl3+2HI=2FeCl2+2HCl+I2
(1)反应②的反应类型为___(填字母)。
A.置换反应 B.复分解反应 C.分解反应 D.氧化还原反应
(2)对于反应③,氧化产物是___,还原产物是___。
(3)根据上述三个反应可判断出Cl-、I-、Fe2+三种物质的还原性由强到弱顺序为___。
II.实验室可以用 KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:__KMnO4+__HCl(浓)-__KCl+__MnCl2+__Cl2↑+__H2O,回答下列问题:
(1)请配平上述化学方程式。___
(2)浓盐酸在反应中表现的性质是___。
(3)该反应中氧化剂和还原剂的物质的量之比为___。
III.饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,请回答下列问题:
(1)上述反应中,被还原的物质是___。
(2)用双线桥标出反应中电子转移的方向和数目。___
(3)上述反应中若标准状况下产生11.2L气体,则转移电子的数目为___。
【答案】D I2 FeCl2 I >Fe2+>Cl 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 酸性,还原性 1:5 NaNO3 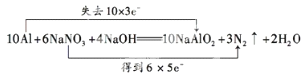 5NA
5NA
【解析】
I.(1)依据反应类型进行归类;
(2)依据氧化还原反应的概念分析;
(3)依据氧化还原反应的规律由强到弱分析;
II.(1)利用电子守恒配平;
(3)依据电子守恒计算。
I.(1) 反应②的反应类型从物质的组成看属于化合反应,从化合价是否发生变化分析是氧化还原反应,故选:D.
(2) 对于反应③,铁元素的化合价降低,所以FeCl2是还原产物,碘元素的化合价升高,所以碘单质是氧化产物,
故答案为:I2;FeCl2.
(3)反应的还原剂是I,还原产物是Cl,依据氧化还原反应由强到弱规律,还原性:I> Cl,同理反应,还原剂是Fe2+,还原产物是Cl,还原性Fe2+> Cl,反应还原剂是I,还原产物是Fe2+,还原性I> Fe2+,故还原性强弱顺序是:I >Fe2+>Cl
故答案为:I >Fe2+>Cl
II.(1)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
故答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)浓盐酸中氯元素的化合价部分升高,也有一部分没有发生变化,所以作用是酸性,还原性,
故答案为:酸性,还原性
(3)氧化剂是KMnO4,还原剂是HCl,依据电子守恒的得,氧化剂和还原剂的物质的量之比为1:5,
故答案为:1:5
III.(1)氮元素的化合价降低被还原,所以被还原的是NaNO3,
故答案为:NaNO3
(2)铝作还原剂失去电子,硝酸钠作氧化剂得到电子,转移电子数是30,所以双线桥标出反应中电子转移的方向和数目
(3) 标准状况下产生11.2L气体,则转移电子的数目为N=n×NA=V÷Vm×NA×2×5=11.2L÷22.4L/mol×NA×2×5=5 NA,
故答案:5 NA

 高中必刷题系列答案
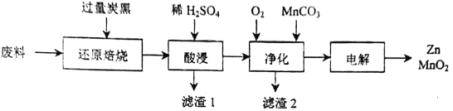
高中必刷题系列答案【题目】废旧电池的回收处理,既能减少对环境的污染,又能实现资源的再生利用。将废旧锌锰电池初步处理后,所得废料含MnO2、MnOOH、Zn(OH)2及少量Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
回答下列问题:
(1)还原焙烧过程中, MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为___________。传统的工艺是使用浓盐酸在加热条件下直接处理废料,缺点是___________。
(2)酸漫时一般会适当加热并不断搅拌,其作用是___________,滤渣1和滤渣2主要成分的化学式依次是___________。
(3)净化时,先通入O2再加入MnCO3,其目的是___________;已知净化时溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,调节pH的合理范围是___________。
(4)电解制取MnO2时,MnO2在___________极产生。
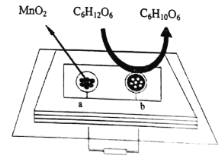
(5)中科院研究人员将MnO2和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为______________________。