题目内容
【题目】锌是一种过渡金属,外观呈现银白色,在现代工业中对于电池制造上有不可磨灭的地位。现代炼锌的方法可分为火法和湿法两大类.硫酸铅是生产锌的副产品。
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1473-1573K,使锌蒸馏出来。将闪锌矿焙烧使它转化为氧化锌的主要化学反应方程式为。
(2)某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
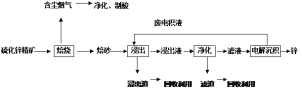
回答下列问题:
①焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
②浸出液“净化”过程中加入的主要物质为锌粉,其作用是。
③改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________
(3)工业冶炼锌的过程中,会产生铅浮渣(主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质),某科研小组研究利用铅浮渣生产硫酸铅的流程如下:
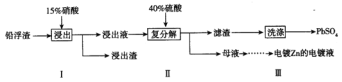
已知:25℃时,Ksp(CaSO4)=4.9×10-5,KSP(PbSO4)=1.6×10-8。
①已知步骤Ⅰ有NO气体产生,浸出液中含量最多的阳离子是Pb2+。写出Pb参加反应的化学方程式_____________________。
②步骤Ⅰ需控制Pb的用量并使Pb稍有剩余,目的是使Ag留在浸出渣中,产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去附着在硫酸铅表面的微溶物硫酸钙。沉淀转化反应的离子方程式是___。
③母液中可循环利用的溶质的化学式是_____________(填一种物质)
(4)现向含Pb2+、Ca2+浓度均为0.10mol/L的混合溶液中滴加0.10mol/LSO42-溶液.当Pb2+沉淀完全时,溶液中Ca2+浓度为mol/L
【答案】(1)2ZnS+3O2![]() 2ZnO+2SO2
2ZnO+2SO2
(2)①浸出②置换出Fe等,以达到净化的目的
③2ZnS+4H++O2=2Zn2++2S↓+2H2O
(3)①3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O
②CaSO4(s)+Pb2+(aq)=PbSO4(s)+Ca2+(aq)③HNO3(4)0.03
【解析】
试题分析:(1)由题中信息可知,闪锌矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌,反应的化学方程式为2ZnS+3O2![]() 2ZnO+2SO2;
2ZnO+2SO2;
(2)①ZnS在氧气燃烧发生氧化还原反应生成产物出来氧化锌外还有硫的氧化物,可转换为硫酸,用于后续的浸出操作;
②该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉除去亚铁离子,离子方程式:Zn+Fe2+=Zn2++Fe;
③“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,反应的化学方程式为2ZnS+4H++O2=2Zn2++2S↓+2H2O;
(3)①根据题给信息硝酸把铅氧化成Pb2+,硝酸被还原成NO,故反应方程式为3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;
②硫酸钙微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗涤,除去CaSO4,反应的离子方程式为CaSO4(s)+Pb2+(aq)=PbSO4(s)+Ca2+(aq);
③Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸,所以母液可循环利用于步骤I,即可循环利用的物质是HNO3;
(4)根据硫酸钙和硫酸铅的溶度积常数可知溶液中![]() ,所以当Pb2+沉淀完全时,溶液中Ca2+浓度为
,所以当Pb2+沉淀完全时,溶液中Ca2+浓度为![]() 。
。

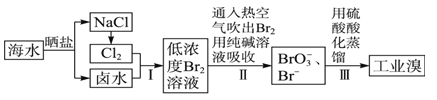
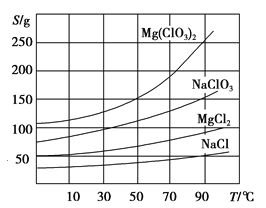
【题目】NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出此化学反应方程式 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液的变质情况。
限选试剂为:98%浓硫酸、1%品红溶液、1.0 mol·L-1 KI-淀粉溶液、1.0 mol·L-1NaOH、
澄清石灰水、饱和NaCl溶液
请完成下列探究实验方案。
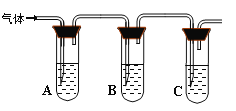
所加试剂 | 预期现象和结论 |
试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② 。 | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊。则消毒液部分变质; ③ 则消毒液未变质; ④ 则消毒液完全变质。 |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
① 量取 25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液b mL;
② 滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不褪时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO+Na2SO3=NaCl+Na2SO4;
2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O
③ 计算消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、v的代数式表示)。
【题目】在一定条件下,X既能与Y反应又能与Z反应,且都属于复分解反应的是
选项 | X | Y | Z |
A | Cu | HNO3 | Fe(NO3)3 |
B | FeCl3 | Zn | NaHCO3 |
C | O2 | NH3 | SO2 |
D | NH4Al(SO4)2 | Ba(NO3)2 | NaOH |
A. A B. B C. C D. D
【题目】根据表中的信息判断下列说法正确的是
物质 | 金刚石 | 石墨 |
外观 | 无色,透明固体 | 灰黑,不透明固体 |
熔点 | ? | ? |
燃烧热/kJ·mol-1 | 395.4 | 393.5 |
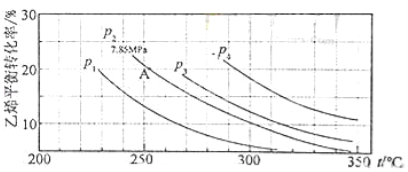
A.表示石墨燃烧热的热化学方程式为C(石墨,s)+1/2O2(g)=CO(g) △H=-393.5 kJ·mol-1
B.由表中信息知C(石墨,是s)=C(金刚石,s) △H=+1.9 kJ·mol-1
C.由表中信息可得如图所示的图像

D.由表中信息可推知相同条件下金刚石的熔点高于石墨的熔点