题目内容
工业上制备纯硅的反应为:SiCl4(g)+2H2(g)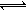 Si(s)+4HCl(g)△H=+236kJ/mol,将一定量反应物通入密闭容器进行以上可逆反应,既能提高SiCl4的转化率又能缩短达到平衡的时间的是
Si(s)+4HCl(g)△H=+236kJ/mol,将一定量反应物通入密闭容器进行以上可逆反应,既能提高SiCl4的转化率又能缩短达到平衡的时间的是
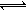 Si(s)+4HCl(g)△H=+236kJ/mol,将一定量反应物通入密闭容器进行以上可逆反应,既能提高SiCl4的转化率又能缩短达到平衡的时间的是
Si(s)+4HCl(g)△H=+236kJ/mol,将一定量反应物通入密闭容器进行以上可逆反应,既能提高SiCl4的转化率又能缩短达到平衡的时间的是| A.增大压强 | B.减小氢气浓度 | C.升高温度 | D.加入催化剂 |
C
根据方程式可知,正反应是体积增大的,所以增大压强,平衡向逆反应方向移动,反应物的转化率降低,A不正确;减小氢气浓度,反应速率降低,平衡向逆反应方向移动,
反应物的转化率降低,B不正确;正反应是吸热反应,所以升高温度,平衡向正反应方向移动,反应物的转化率增大,C正确;催化剂只能改变反应速率,但不能改变平衡状态,选项D不正确,所以答案选C。
反应物的转化率降低,B不正确;正反应是吸热反应,所以升高温度,平衡向正反应方向移动,反应物的转化率增大,C正确;催化剂只能改变反应速率,但不能改变平衡状态,选项D不正确,所以答案选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。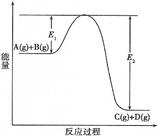
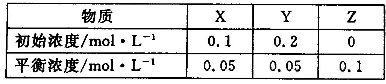
 2Z
2Z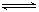 CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol?L-1,c(H2O)=6.0mol?L-1,c(CO2)=3.0mol?L-1,c(H2)= 4.5mol?L-1,则此时该反应向_________方向移动。
CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol?L-1,c(H2O)=6.0mol?L-1,c(CO2)=3.0mol?L-1,c(H2)= 4.5mol?L-1,则此时该反应向_________方向移动。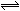 CO2(g) +H2(g);△H=-43kJ·mol-1对于此反应,下列措施中能提高CO转化率的是
CO2(g) +H2(g);△H=-43kJ·mol-1对于此反应,下列措施中能提高CO转化率的是 CO2(g) +H2(g),平衡后测得CO2为0.6mol,再通入4mol水蒸气,达新平衡后CO2的物质的量可能是
CO2(g) +H2(g),平衡后测得CO2为0.6mol,再通入4mol水蒸气,达新平衡后CO2的物质的量可能是 2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
 CO2(g)+H2(g);△H<0 试回答下列问题:
CO2(g)+H2(g);△H<0 试回答下列问题: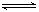 N2O4(g) ΔH <0,达到平衡后,下列说法不正确的是
N2O4(g) ΔH <0,达到平衡后,下列说法不正确的是