题目内容
830K时,在密闭容器中发生下列可逆反应:

 CO(g)+H2O(g)
CO(g)+H2O(g) CO2(g)+H2(g);△H<0 试回答下列问题:
CO2(g)+H2(g);△H<0 试回答下列问题:
 (1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
 (2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”), 此时v(正)正) v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”), 此时v(正)正) v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
 (3)若降低温度,该反应的K值将 (均填“增大”“减小”或“不变”)。
(3)若降低温度,该反应的K值将 (均填“增大”“减小”或“不变”)。

 CO(g)+H2O(g)
CO(g)+H2O(g) CO2(g)+H2(g);△H<0 试回答下列问题:
CO2(g)+H2(g);△H<0 试回答下列问题: (1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= . (2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”), 此时v(正)正) v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”), 此时v(正)正) v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是 。 (3)若降低温度,该反应的K值将 (均填“增大”“减小”或“不变”)。
(3)若降低温度,该反应的K值将 (均填“增大”“减小”或“不变”)。(1)平衡常数K= 1
(2) 否 大于
依据是Q="0.5×0.5/0.5×1.5" <1,即Q<K。所以未达平衡,V(正)>V(逆)
(3)增大
(2) 否 大于
依据是Q="0.5×0.5/0.5×1.5" <1,即Q<K。所以未达平衡,V(正)>V(逆)
(3)增大
(1)达到平衡时CO的转化率为60%,则生成CO2和氢气的浓度都是1.2mol/L,此时CO和水蒸气的浓度分别是0.8mol/L、1.8mol/L,所以该反应的平衡常数是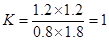 。
。
(2)反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时CO2也是0.5mol/L,而CO和氢气分别是0.5mol/L和1.5mol/L,所以有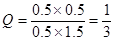 ,即Q<K。所以未达平衡,V(正)>V(逆)。
,即Q<K。所以未达平衡,V(正)>V(逆)。
(3)正反应是放热反应,降低温度,平衡向正反应方向进行,所以平衡常数增大。
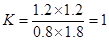 。
。(2)反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时CO2也是0.5mol/L,而CO和氢气分别是0.5mol/L和1.5mol/L,所以有
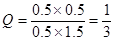 ,即Q<K。所以未达平衡,V(正)>V(逆)。
,即Q<K。所以未达平衡,V(正)>V(逆)。(3)正反应是放热反应,降低温度,平衡向正反应方向进行,所以平衡常数增大。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
 2Z(g)+W(g);ΔH>0。达平衡时,A的体积为1.2aL。下列说法错误的是
2Z(g)+W(g);ΔH>0。达平衡时,A的体积为1.2aL。下列说法错误的是
 Si(s)+4HCl(g)△H=+236kJ/mol,将一定量反应物通入密闭容器进行以上可逆反应,既能提高SiCl4的转化率又能缩短达到平衡的时间的是
Si(s)+4HCl(g)△H=+236kJ/mol,将一定量反应物通入密闭容器进行以上可逆反应,既能提高SiCl4的转化率又能缩短达到平衡的时间的是 2SO3,下列叙述能够说明反应已经达到平衡状态的是( )
2SO3,下列叙述能够说明反应已经达到平衡状态的是( ) N2O4 △H<0,若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度,其中不变的是( )
N2O4 △H<0,若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度,其中不变的是( )
 2B(g)+C(g);正反应吸热,达平衡时,要使v(正)降低、c(A)增大,应采取( D )
2B(g)+C(g);正反应吸热,达平衡时,要使v(正)降低、c(A)增大,应采取( D )