题目内容
7.(I)在 K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O反应中.(1)Cl元素被氧化,K2Cr2O7是氧化剂.
(2)在该反应中若有0.5mol K2Cr2O7被还原,则被氧化的HCl的物质的量为3mol.
(Ⅱ)将2.0gNaOH溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为90g.
分析 (I)(1)氧化还原反应中,化合价升高的元素被氧化,对应产物是氧化产物,化合价降低元素被还原,所在的反应物是氧化剂,发生还原反应;
(2)根据化学方程式得失电子守恒来计算回答;
(Ⅱ)利用n=$\frac{m}{M}$计算Na的物质的量,由Na原子守恒可知,n(Na)=n(Na+),再利用100个水分子中溶有1个钠离子来列式计算出水的物质的量及其质量.
解答 解:(I)(1)氧化还原反应K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2+7H2O反应中,化合价升高的元素Cl元素被氧化,对应产物Cl2是氧化产物,化合价降低元素Cr被还原,所在的反应物K2Cr2O7是氧化剂,发生还原反应,
故答案为:Cl;K2Cr2O7;
(2)氧化还原反应K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O中,化合价降低元素Cr得电子,此反应若有0.5mol K2Cr2O7被还原,则转移电子数为0.5×(6-3)×2=3mol,所以被氧化的HCl的物质的量为3mol,故答案为:3;
(Ⅱ)NaOH的物质的量=$\frac{2.0g}{40g/mol}$=0.05mol,根据原子守恒得n(NaOH)=n(Na+)=0.05mol,使100个水分子中含有1个Na+,则溶液中水的物质的量=100n(Na+)=100n(Na)=5mol,
则需要水的质量=5mol×18g/mol=90g,
故答案为:90g
点评 本题考查学生氧化还原反应的基本概念和电子转移知识以及物质的量的计算,可以根据所学知识进行回答,难度并不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.在同温同压下,下列各组热化学方程式中,△H1>△H2的是( )
| A. | 2H2(气)+O2(气)═2H2O(气)△H1 2H2(气)+O2(气)═2H2O(液)△H2 | |
| B. | S(气)+O2(气)═SO2(气)△H1 S(固)+O2(气)═SO2(气)△H2 | |
| C. | C(固)+O2(气)═CO2(气)△H1 C(固)+$\frac{1}{2}$O2 (气)═CO(气)△H2 | |
| D. | H2(气)+Cl2(气)═2HCl(气)△H1 $\frac{1}{2}$H2(气)+$\frac{1}{2}$Cl2(气)═HCl(气)△H2 |
12.对下列有机反应类型的认识,错误的是( )
| A. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应 | |
| B. | CH2=CHCH3+Br2$\stackrel{光照}{→}$CH2=CHCH2Br+HBr;加成反应 | |
| C. | 2CH3CH2OH+O2→2CH3CHO+2H2O;氧化反应 | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$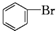 +HBr;取代反应 +HBr;取代反应 |
17.下列溶液中滴加氢氧化钠或氯化钡溶液时,均有白色沉淀生成的是( )
| A. | 氯化钠 | B. | 硫酸镁 | C. | 碳酸钠 | D. | 氢氧化钾 |
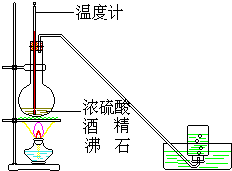 如图是实验室用乙醇与浓硫酸共热制乙烯的实验装置
如图是实验室用乙醇与浓硫酸共热制乙烯的实验装置 .
.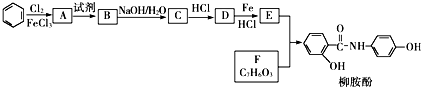
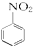 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$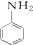
 .
. .
. 、
、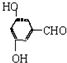 、
、 (写出2种).
(写出2种).