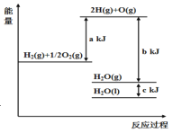
题目内容
【题目】图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极)微观示意图。
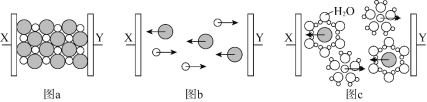
下列说法不正确的是
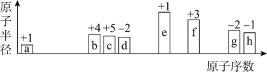
A.图示中的![]() 代表的离子的电子式为
代表的离子的电子式为![]()
B.图a中放入的是氯化钠固体,该条件下不导电
C.能导电的装置中,X上均有气体产生
D.能导电的装置中,Y的电极产物相同
【答案】D
【解析】
图a表示NaCl晶体,由于NaCl晶体中含有Na+和Cl-,而Cl-的电子层数比Na+多一层,所以Cl-半径大于Na+半径;图b表示熔融的NaCl,通直流电后,Cl-向阳极移动,则X极为阳极,Y极为阴极;图c表示电解NaCl的水溶液。
A.图示中的![]() 代表的离子为Cl-,电子式为
代表的离子为Cl-,电子式为![]() ,A正确;
,A正确;
B.由以上分析知,图a中放入的是氯化钠固体,该条件下离子不能自由移动,固体不导电,B正确;
C.图b和图c装置中,电解质都能导电,X为阳极,都发生反应2Cl--2e-==Cl2↑,均有气体产生,C正确;
D.图b和图c装置都能导电,图b中Y的电极产物为Na,图c中Y的电极产物为H2等,D不正确;
故选D。

 名校课堂系列答案
名校课堂系列答案【题目】800℃时,三个相同的恒容密闭容器中发生反应CO(g) + H2O(g)![]() CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
容器编号 | 起始浓度/(mol·L1) | |||
c(CO) | c(H2O) | c(CO2) | c(H2) | |
Ⅰ | 0.01 | 0.01 | 0 | 0 |
Ⅱ | 0 | 0 | 0.01 | 0.01 |
III | 0.008 | 0.008 | 0.002 | 0.002 |
下列说法不正确的是
A.Ⅱ 中达平衡时,c(H2)=0.005 mol·L1
B.III中达平衡时,CO的体积分数大于25%
C.III中达到平衡状态所需的时间比 Ⅰ 中的短
D.若III中起始浓度均增加一倍,平衡时c(H2)亦增加一倍
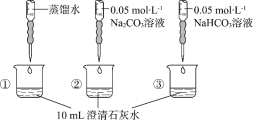
【题目】实验小组利用传感器探究Na2CO3和NaHCO3的性质。
实验操作 | 实验数据 |
测量下述实验过程的pH变化
|
|
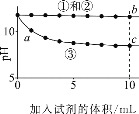
下列分析不正确的是
A.①与②的实验数据基本相同,说明②中的OH-未参与该反应
B.加入试剂体积相同时,②所得沉淀质量大于③所得沉淀质量
C.从起始到a点过程中反应的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
D.b点对应溶液中水的电离程度小于c点对应溶液中水的电离程度