题目内容
(2014届山东省烟台市高三3月模拟化学试卷)
硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5?H2O,硼砂的化学式为Na2B4O7?10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
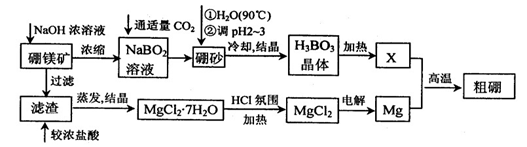
回答下列有关问题:
(1)硼砂中B的化合价为 ,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为 。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为 。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为 。已知Ksp[Mg(OH)2]=5.6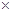 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为 滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 。(提示:I2+2S2O32-=2I-+S4O62-)
硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5?H2O,硼砂的化学式为Na2B4O7?10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)硼砂中B的化合价为 ,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为 。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为 。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为 。已知Ksp[Mg(OH)2]=5.6
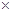 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为 滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 。(提示:I2+2S2O32-=2I-+S4O62-)
(1)+3(2分) B4O72-+2H++5H2O= 4H3BO3(2分)Mg+B2O3===2B+3MgO(2分)
(2)防止MgCl2水解生成Mg(OH)2(2分)
2H2O+Mg2++2e-= H2↑+Mg(OH)2↓(2分)
(3)H2O2+2H++2e-=2H2O(2分) 0.045 mol·L-1(2分) 没有(2分)
(4)碱式(2分) 99%(2分)
(2)防止MgCl2水解生成Mg(OH)2(2分)
2H2O+Mg2++2e-= H2↑+Mg(OH)2↓(2分)
(3)H2O2+2H++2e-=2H2O(2分) 0.045 mol·L-1(2分) 没有(2分)
(4)碱式(2分) 99%(2分)
(1)根据硼砂的化学式Na2B4O7?10H2O和化合价的代数和为0,可得B的化合价为+3;B4O72-与2H+反应可得H3BO3,离子方程式为:B4O72-+2H++5H2O= 4H3BO3;X为H3BO3晶体加热脱水的产物,为B2O3,与Mg发生氧化还原反应,化学方程式为:Mg+B2O3===2B+3MgO。
(2)MgCl2为强酸弱碱盐,能发生水解反应,所以MgCl2·7H2O在HCl氛围中加热的目的是:防止MgCl2水解生成Mg(OH)2;用惰性电极电解MgCl2溶液,阴极反应为H2O电离出的H+放电,电解方程式为:2H2O+Mg2++2e-= H2↑+Mg(OH)2↓
(3)镁-H2O2酸性燃料电池的正极为H2O2放电,电极方程式为:H2O2+2H++2e-=2H2O;起始电解质溶液pH=1,pH=2时反应的H+为:0.1mol?L?1—0.01mol?L?1=0.09mol?L?1,根据Mg+H2O2+2H+==Mg2++2H2O,可得Mg2+离子浓度为0.045 mol·L-1;溶液pH=6时,c(OH?)=10-8mol?L?1,Q [Mg(OH)2]=" 0.045" mol·L-1×[10-8mol?L?1]2=4.5×10-18 < Ksp[Mg(OH)2],所以没有Mg(OH)2沉淀析出。
(4)Na2S2O3为强碱弱酸盐,水解显碱性,所以Na2S2O3溶液应盛放在碱式滴定管内;根据元素守恒和离子方程式可得:2B ~ 2BI3 ~ 3I2 ~ 6 S2O32-,所以粗硼样品的纯度为:0.018L×0.30mol?L?1×1/3×11g/mol÷×100% = 99%

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


 2CO2(g)+ N2(g)△H <0
2CO2(g)+ N2(g)△H <0
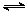 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
 Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。


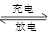 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )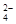 – 2e – = PbSO4
– 2e – = PbSO4