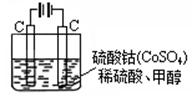
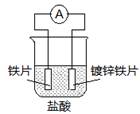
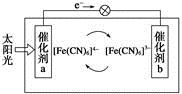
题目内容
X、Y、Z、M、N代表五种金属,有以下反应:
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)=Z(OH)2+H2↑;
④水溶液中,X+Y2+=X2++Y。
则这五种金属的活动性由强到弱的顺序为( )
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)=Z(OH)2+H2↑;
④水溶液中,X+Y2+=X2++Y。
则这五种金属的活动性由强到弱的顺序为( )
| A.Z>X>Y>M>N | B.Z>Y>X>M>N |
| C.Z>X>Y>N>M | D.X>Y>M>N>Z |
A
试题分析:①Y与M用导线连接放入稀硫酸中,M上冒气泡;证明M为原电池是正极,所以活动性Y>M;②在原电池反应中,电子流出的电极为负极,电子流入的电极为正极,由于电子从M极流出,经过外电路,流入N极,所以活动性M>N;③Z+2H2O(冷水)=Z(OH)2+H2↑。证明Z的活动性很强。在题目提供的所有的元素中是最强的。④水溶液中,X+Y2+=X2++Y,则证明活动性X>Y。所以这五种金属的活动性由强到弱的顺序为Z>X>Y>M>N 。选项为A。

练习册系列答案
相关题目


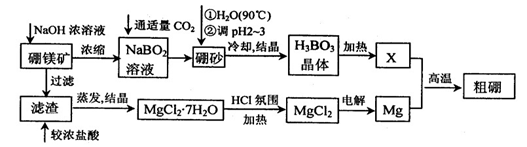
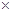 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。