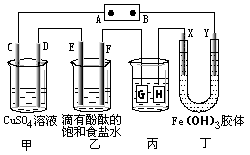
题目内容
【题目】向盛有少量CuCl2溶液的试管中滴入少量NaOH溶液,再滴入适量浓氨水,下列叙述不正确的是( )
A. 开始生成蓝色沉淀,加入过量氨水时,形成无色溶液
B. 开始生成Cu(OH)2,它不溶于水,但溶于浓氨水,生成深蓝色溶液
C. 开始生成蓝色沉淀,加入氨水后,沉淀溶解生成深蓝色溶液
D. 开始生成Cu(OH)2,之后生成更稳定的配合物
【答案】A
【解析】向CuCl2溶液中加入少量NaOH溶液,生成Cu(OH)2蓝色沉淀:Cu2++2OH-===Cu(OH)↓;再加入浓氨水,沉淀溶解得到深蓝色的溶液:Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O。答案选A。

【题目】碘及其化合物在生产、生活中具有重要作用。请按要求回答下列问题:
(1)海带灰浸取液中的碘元素以I-形式存在。现利用如下试剂:MnO2、稀硫酸、淀粉溶液,从中获取单质碘。请按要求完善下表:
序号 | 所选试剂 | 反应原理或现象或解释 |
方法1 | MnO2、稀硫酸 | 离子方程式:________ |
方法2 | 稀硫酸、淀粉溶液 | 溶液变蓝的原因。用离子方程式解释: ____________ |
(2)反应2HI(g) ![]() H2(g)+I2(g)的能量变化如图1所示:其他条件相同,1molHI在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示。
H2(g)+I2(g)的能量变化如图1所示:其他条件相同,1molHI在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示。
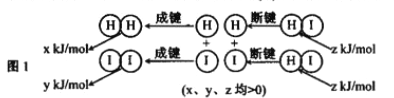

①比较2z______(x+y)(填 “<"、“>”或“=”).
②某温度下该反应的平衡常数K=1/9,达平衡时,HI的转化率=___________。
③只改变该反应的一个条件,试写出能提高HI转化率的两项措施:__________、_________。
(3)已知:i.分解1molH2O2放出热量98kJ;ⅱ.含少量I-的溶液中,H2O2的分解机为: H2O2+I-![]() H2O+IO-慢;H2O2+IO-
H2O+IO-慢;H2O2+IO-![]() H2O+O2+I-快。ⅲ.H2O2分解速率受多种因素影响,实验测得某温度时不同条件下H2O浓度随时间的变化如图3、4所示:
H2O+O2+I-快。ⅲ.H2O2分解速率受多种因素影响,实验测得某温度时不同条件下H2O浓度随时间的变化如图3、4所示:
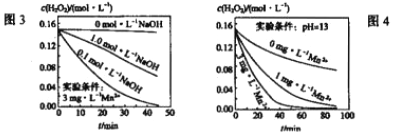
请完善由以上信息可得到的如下结论:
①H2O2分解反应的热化学方程式为___________。
②H2O2的分解速率与_________有关。
③“少量Mn2+存在时,溶液碱性越强H2O2分解速率越大”的结论是否正确_______(填“是"或“否”);c(Mn2+)对H2O分解速率的影响是__________。