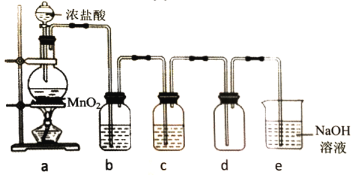
题目内容
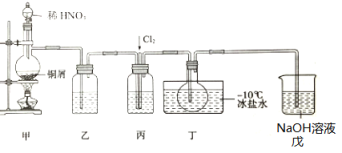
【题目】亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点-64.5℃,沸点-5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成,某化学兴趣小组设计如图装置制备NOC1。回答下列相关问题:
(1)NOCl分子中各原子均满足8电子稳定结构,NOCl的电子式为___。
(2)装置乙中的液体为___,装置丙作用是___。
(3)实验时,先通入Cl2,观察到丁中烧瓶内充满黄绿色气体时,再通入NO,这样操作目的是___。待丁中烧瓶内有一定量液体生成时,停止实验。
(4)上述装置设计有一不妥之处,理由是___(用化学方程式表示)。
(5)测定NOCl的纯度:取所得产物a g溶于水,配制成250mL溶液;取25.00mL于锥形瓶中,以K2Cr2O7溶液为指示剂,用c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为24.00mL。滴定终点的现象是___,亚硝酰氯(NOCl)的纯度为___。(Ag2CrO4砖红色:Ksp(AgCl)=1.56x10-10,Ksp(Ag2CrO4)=1.0x10-12,Ksp(AgNO2)=5.86×10-4)。
【答案】![]() 水 干燥Cl2和NO,混合Cl2和NO,并通过观察气泡调节通入的流速使Cl2和NO的量接近1:2 排尽装置内的空气,防止NO被氧化 NOCl+H2O=HNO2+HCl 滴入最后一滴标准液,生成砖红色沉淀,且半分钟无变化
水 干燥Cl2和NO,混合Cl2和NO,并通过观察气泡调节通入的流速使Cl2和NO的量接近1:2 排尽装置内的空气,防止NO被氧化 NOCl+H2O=HNO2+HCl 滴入最后一滴标准液,生成砖红色沉淀,且半分钟无变化 ![]() ×100%
×100%
【解析】
甲中稀硝酸和Cu反应产生NO;硝酸易挥发,NO中混有HNO3,将混合气体通过盛有水的乙除去HNO3;将NO和Cl2通入丙中进行干燥、混合,同时通过气泡速率控制NO和Cl2的量;NO和Cl2在丁装置的烧瓶中反应得NOCl,用冰盐水冷凝得NOCl液体,用戊吸收尾气,据此解答。
(1)NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)乙的作用是吸收NO中混有的HNO3,HNO3易溶于水,NO不溶于水,可用水吸收NO中混有的HNO3;NOCl遇水水解,在制备NOCl之前应将水吸收干燥,可盛放浓硫酸。同时装置乙可将NO和Cl2混合,根据原子守恒可知:Cl2和NO物质的量之比为1:2时恰好完全反应,可以通过观察丙中气泡调节通入的流速使Cl2和NO的量接近1:2,故答案为:水;干燥Cl2和NO,混合Cl2和NO,并通过观察气泡调节通入的流速使Cl2和NO的量接近1:2;
(3)实验之前,装置内有空气,NO能被空气中的氧气迅速氧化,为防止NO被氧气氧化,实验时,先通入Cl2,观察到丁中烧瓶内充满黄绿色气体时,空气被排尽,此时再通入NO,故答案为:排尽装置内的空气,防止NO被氧化;
(4)戊装置中有水,水蒸气进入装置丁的烧瓶中使NOCl水解,发生的反应为:NOCl+H2O=HNO2+HCl,故答案为:NOCl+H2O=HNO2+HCl;
(5)Ksp(AgCl)=1.56x10-10,Ksp(Ag2CrO4)=1.0x10-12,Ksp(AgNO2)=5.86×10-4),三种饱和溶液中c(Ag+)分别为:c(Ag+)=![]() ,c(Ag+)=
,c(Ag+)=![]() ,c(Ag+)=
,c(Ag+)=![]() ,即溶解度:AgCl<Ag2CrO4<AgNO2,滴加标准AgNO3溶液时,形成沉淀顺序:AgCl、Ag2CrO4、AgNO2,所以,当滴入最后一滴标准液,生成砖红色沉淀,且半分钟无变化时,到达滴定终点;NOCl溶于水发生的反应为:NOCl+H2O=HNO2+HCl,用AgNO3标准溶液滴定时发生的反应为:HCl+AgNO3=AgCl↓+HNO3,则有如下关系:NOCl~HCl~AgNO3,消耗AgNO3的物质的量=24c×10-3mol,由NOCl~HCl~AgNO3可得:NOCl的物质的量=24c×10-3mol,所以,a g样品中NOCl的物质的量=24c×10-3mol×
,即溶解度:AgCl<Ag2CrO4<AgNO2,滴加标准AgNO3溶液时,形成沉淀顺序:AgCl、Ag2CrO4、AgNO2,所以,当滴入最后一滴标准液,生成砖红色沉淀,且半分钟无变化时,到达滴定终点;NOCl溶于水发生的反应为:NOCl+H2O=HNO2+HCl,用AgNO3标准溶液滴定时发生的反应为:HCl+AgNO3=AgCl↓+HNO3,则有如下关系:NOCl~HCl~AgNO3,消耗AgNO3的物质的量=24c×10-3mol,由NOCl~HCl~AgNO3可得:NOCl的物质的量=24c×10-3mol,所以,a g样品中NOCl的物质的量=24c×10-3mol×![]() =24c×10-2mol,样品中NOCl的质量=24c×10-2mol×65.5g/mol=15.72c g,所以NOCl的纯度=
=24c×10-2mol,样品中NOCl的质量=24c×10-2mol×65.5g/mol=15.72c g,所以NOCl的纯度=![]() ×100%=
×100%=![]() ×100%,故答案为:滴入最后一滴标准液,生成砖红色沉淀,且半分钟无变化;
×100%,故答案为:滴入最后一滴标准液,生成砖红色沉淀,且半分钟无变化;![]() ×100%。
×100%。

【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产高纯度LiOH的工艺流程如图:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)

(1)含锂电解铝废渣与浓硫酸在200~400℃条件下反应2h。“滤渣1”主要成分是___(填化学式)。
(2)“过滤2”需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是___。
(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40°C下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为___;若碱解前滤液中c(Li+)=4molL-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则“滤液2”中c(CO32-)=___molL-1。[Ksp(Li2CO3)=1.6×10-3]
(4)“苛化”过程,若氧化钙过量,则可能会造成___。
(5)整个工艺流程中可以循环利用的物质有___。
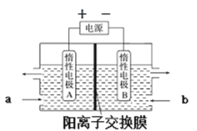
(6)“电解”原理如图所示。“碳化”后的电解液应从(填“a”或“b”)___口注入。阴极的电极反应式为___。
(7)高纯度LiOH可转化为电池级Li2CO3。将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式为___。