��Ŀ����
����Ŀ��Na2O2����ѧ��ѧ���õ�ǿ����������������CO2��H2O��Ӧ�⣬������������ԭ����H2��C������Ӧ��ij��ѧ������ȤС��Ϊ̽��Na2O2��H2�ķ�Ӧ��������������ͼ��ʾװ�ý����й�ʵ�顣
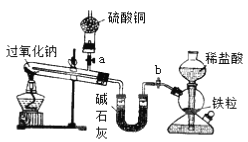
��1����װ���У������������շ�����֮���װ�õ������ԣ�_________________________________��
��2������ɸ�ʵ����йز������衣
�ټ��װ�������ԣ�
�ڴ�a��b�����������۲��Թ������ʵ���ɫ�仯��
��____________________________________________________��
�ܼ��ȹ������ƣ��۲��Թ������ʵ���ɫ�仯��
�ݷ�Ӧ��ȫ��__________________________________________��
��жװ�á�
��3����װ���У���ʯ�ҵ�������_________________________ ��
��4��ʵ������й۲쵽(2)�в���������Ա仯�������Na2O2�ۻ���ɫ��ĩ������ɰ�ɫ�������������ͭδ�����ɫ����Na2O2��H2��Ӧ�Ļ�ѧ����ʽΪ_________��
���𰸡� �ر�a����b������һ���ܲ�����ˮ���У����������Թ�(�����Լ����Թ�)�����۲쵽���ܿ�������ð������ȴ�Թܺ������γ�һ���ȶ���ˮ������˵��װ������������ �ڸ�����ϵ���һ֧С�Թ��ռ�H2������H2�Ĵ��� �ȳ���ƾ��ƣ����Թ���ȴ��ر�b ��ȥH2�е�HCl��ˮ���� Na2O2��H2![]() 2NaOH
2NaOH
���������������������ͨ��̽��Na2O2��H2�ķ�Ӧ������װ�������Եļ�飬����ʵ�鲽�裬ʵ������ķ�������ѧ����ʽ����д��
��1���������շ�����֮���װ�õ������Կ����ȷ����������Ϊ���ر�a����b������һ���ܲ�����ˮ���У����������Թ��������Լ����Թ��������۲쵽���ܿ�������ð������ȴ�Թܺ������γ�һ���ȶ���ˮ������˵��װ��������������
��2������������̽��H2��Na2O2�������ܷ�Ӧ��ͬʱ�ɽ�װ���п����ų������������ȹ������ƣ�����̽��H2��Na2O2����ʱ�ķ�Ӧ������Ҫ���ȣ���H2����ʱ�ᷢ����ը�����Լ��ȹ�������֮ǰҪ����H2�Ĵ��ȣ�������Ϊ�ڸ�����ϵ���һ֧С�Թ��ռ�H2������H2�Ĵ��ȡ�ʵ�����ʱ��Ϊ�˷�ֹ�������Ӹ���ܽ����Թ���ʹH2����������ը��������Ӧ�ȳ���ƾ��ƣ����Թ���ȴ��ر�b�������Թ���ȴ��ֹͣͨ��H2����
��3����������ϡ���ᷴӦ�Ƶõ�H2�л���HCl��H2O��g����HCl��H2O��g��������Na2O2��Ӧ������̽��Na2O2��H2�ķ�Ӧ����ʯ�ҵ������dz�ȥH2�е�HCl��H2O��g����
��4���������������Ա仯��Na2O2��H2�����²���Ӧ��������Na2O2�ۻ�����ɫ��ĩ��ɰ�ɫ�������������ͭδ�����ɫ��˵����Ӧû������H2O��˵��Na2O2��H2����ʱ��Ӧ����NaOH����Ӧ�Ļ�ѧ����ʽΪNa2O2+H2![]() 2NaOH��
2NaOH��

 ��У����ϵ�д�
��У����ϵ�д�
