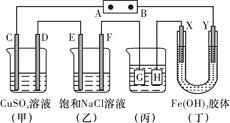
题目内容
下列叙述中错误的是
| A.电解池是电能转化为化学能的装置 |
| B.原电池跟电解池链接后,电子从原电池负极流向电解池阳极 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.用惰性电极电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 |
B
解析试题分析:原电池跟电解池链接后,电子从原电池负极流向电解池阴极故B错误.
考点:原电池和电解池的工作原理

练习册系列答案
相关题目
下列关于金属腐蚀与防护的说法错误的是
| A.当镀锡铁制品的镀层破损时,镀层不再对铁制品起保护作用 |
| B.在空气与水面交接处的钢柱,比在水下部分的钢柱容易腐蚀 |
| C.钢铁不论发生析氢腐蚀还时吸氧腐蚀,其负极反应都为Fe-2e-=Fe2+ |
| D.将输油管道与电源的正极相连的防护方法叫做牺牲阳极的阴极保护法 |
银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。有关说法正确的是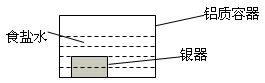
| A.该处理过程中电能转化为化学能 |
| B.银器为正极,Ag2S还原为单质银 |
| C.Ag2S溶解于食盐水生成了AgCl |
| D.铝质容器为阳极,其质量变轻 |
下列关于下图装置的说法正确的是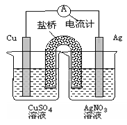
| A.银电极是负极 |
| B.铜电极上发生的反应为Cu-2e-=Cu2+ |
| C.外电路中的电子是从银电极流向铜电极。 |
| D.该装置能将电能转化为化学能 |
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是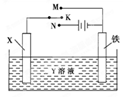
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲 阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小 |
下图为一原电池装置,下列叙述中正确的是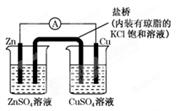
| A.铜是阳极,铜片上有气泡产生 |
| B.盐桥中的K+ 移向ZnSO4溶液 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |
锌—空气电池可能成为未来的理想动力源,该电池的电解质溶液可以是酸性或碱性。在碱性溶液中该电池总反应可表示为:2Zn+4NaOH+O2=2Na2ZnO2 +2H2O。下列有关锌-空气电池说法正确的是
| A.碱性电解质溶液中正极反应式为:4OH-- 4e-= O2↑+2H2O |
| B.碱性或酸性电解质溶液中,该电池正极反应式相同 |
| C.该电池工作时,Na+移向负极 |
| D.每生成1 mol ZnO22-转移电子数为2NA |
以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
| A.电能全部转化为化学能 |
| B.粗铜接电源正极,发生还原反应 |
| C.溶液中Cu2+向阳极移动 |
| D.利用阳极泥可回收Ag、Pt、Au等金属 |