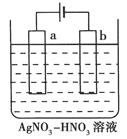
题目内容
6g Mg、Cu合金与一定量的硝酸恰好完全反应,收集到标准状况下VL NO和NO2的混合气体。向反应后的溶液中加入足量NaOH溶液,得到沉淀12.12g。则V的值可能是
| A.2.688 | B.4.48 | C.8.064 | D.8.96 |
B
解析试题分析:Mg、Cu都是+2价的金属,失去的电子数与硝酸得到的电子数相等。Mg则变为Mg(OH)2沉淀,Cu变为Cu(OH)2沉淀。因此变为沉淀的OH-的物质的量与电子转移的物质的量相等。沉淀增加的质量即为OH-的质量。n(OH-)=(12.12-6)g÷17g/mol=0.36mol。n(e-)= n(OH-)=0.36mol。若气体完全为NO,则根据电子守恒可的n(NO)="0.36mol÷3×22.4L/mol=2.688L;" 若气体完全为NO2,则根据电子守恒可的n(NO2)=0.36mol÷1×22.4L/mol=8.064L.但实际上产生的气体既有NO也有NO2。所以放出气体的体积应该在2.688L~8.064L之间。因此选项为B。
考点:考查极端法在计算金属与硝酸反应中的应用的知识。

一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是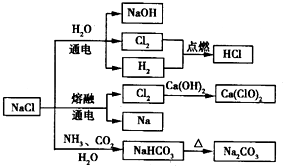
| A.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
| C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D.图中所示转化反应都是氧化还原反应 |
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。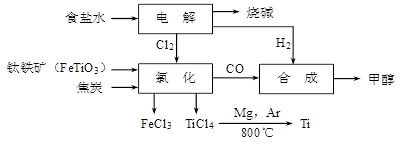
请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图_______。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)氯碱厂获得Cl2的离子方程式为
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 时,理论上Cl2的利用率最大。
200°C时,11.6克CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体的质量增加了3. 6克。从以上信息中,我们得出的下列结论中不正确的是( )
| A.可以计算出混合气体中CO2和水蒸气的质量 |
| B.可以判断出混合气体的平均摩尔质量 |
| C.可以计算出该反应中转移的电子数 |
| D.可以总结出Na2O2任何反应中既作氧化剂也作还原剂 |
在一定条件下,分别以高锰酸钾、氯酸钾和过氧化氢为原料制取氧气,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
| A.1:1:1 | B.2:2:1 | C.2:3:1 | D.4:3:2 |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A.铝片与稀H2SO4反应 |
| B.Ba(OH)2·8H2O与NH4Cl反应 |
| C.灼热的炭与CO2反应 |
| D.甲烷在O2中的燃烧反应 |
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
| A.该合金中铜与镁的物质的量之比是2:1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
往100 mL,pH=0的硫酸和硝酸的混合液中投入3.84 g铜粉,充分反应后,生成NO气体,标准状况下为448 mL,则反应前的混合液中HNO3的物质的量是( )
| A.0.02 mol | B.0.08 mol |
| C.0.10 mol | D.0.16 mol |