题目内容
下列反应既是氧化还原反应,又是吸热反应的是( )
| A.铝片与稀H2SO4反应 |
| B.Ba(OH)2·8H2O与NH4Cl反应 |
| C.灼热的炭与CO2反应 |
| D.甲烷在O2中的燃烧反应 |
C
解析

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案
相关题目
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
| A.与NaOH反应的氯气一定为0.3 mol |
| B.n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
下列叙述正确的是( )
| A.金属元素的原子只有还原性,离子只有氧化性 |
| B.用乙烷(CH3CH3)或乙烯(CH2=CH2)制一氯乙烷(CH3CH2Cl)的反应类型相同 |
| C.煤油是通过煤干馏获得,可用作燃料和保存少量金属钠 |
D.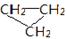 和CH3-CH=CH2互称为同分异构体 和CH3-CH=CH2互称为同分异构体 |
已知Cu+在酸性条件下能发生下列反应:Cu+ → Cu + Cu2+(未配平)。NH4CuSO3与足量的10mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是
| A.气体是二氧化硫 | B.NH4CuSO3中铜元素全部被氧化 |
| C.反应后为硫酸铜溶液 | D.硫酸全部作氧化剂 |
下列关于氧化还原反应的原理分析,正确的是
| A.失电子越多,该物质的还原性就越强 |
| B.含有最高价元素的化合物一定具有强氧化性 |
| C.氧化剂氧化其他物质时,本身被还原 |
| D.某元素由化合态变成游离态一定被还原 |
6g Mg、Cu合金与一定量的硝酸恰好完全反应,收集到标准状况下VL NO和NO2的混合气体。向反应后的溶液中加入足量NaOH溶液,得到沉淀12.12g。则V的值可能是
| A.2.688 | B.4.48 | C.8.064 | D.8.96 |
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。下列说法正确的是
| A.Cu2S既是氧化产物又是还原产物 |
| B.5 mol FeS2发生反应,有10 mol电子转移 |
| C.产物中的SO42-有一部分是氧化产物 |
| D.FeS2只作还原剂 |
有下列三个反应方程式:①Cl2+FeI2=FeCl2+I2 ②2Fe2++Br2=2Fe3++2Br- ③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O,下列说法正确的是 ( )。
| A.①②③中氧化产物分别是FeCl2、Fe3+、Cl2 |
| B.根据以上反应的化学方程式可以得到氧化性强弱关系为Cl2>Co2O3>Fe3+ |
| C.在反应③中生成1 mol Cl2时,有2 mol HCl被氧化 |
| D.根据反应①②一定可以推理得到Cl2+FeBr2=FeCl2+Br2 |
已知NaCN溶液呈碱性,(CN)2与卤素单质的性质相似,CN-的还原性介于Br-、I-之间。下列变化不能发生的是( )
A.HCN H++CN- H++CN- |
| B.(CN)2+CH2=CH2―→NC—CH2—CH2—CN |
| C.(CN)2+2Br-=2CN-+Br2 |
| D.(CN)2+2OH-=CN-+CNO-+H2O |