题目内容
一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是
| A.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
| C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D.图中所示转化反应都是氧化还原反应 |
B
解析试题分析:A、常温下NaHCO3在水中的溶解度比Na2CO3的小,错误;B、氯气与氢氧化钙反应中,氯气既是氧化剂又是还原剂,正确;C、常温下干燥的Cl2能用钢瓶贮存,但在一定条件下能与铁反应,错误;D、碳酸氢钠分解生成碳酸钠的反应不是氧化还原反应,错误,答案选B。
考点:考查化学与工业的关系及氧化还原反应的基本概念

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
下列叙述正确的是( )
| A.金属元素的原子只有还原性,离子只有氧化性 |
| B.用乙烷(CH3CH3)或乙烯(CH2=CH2)制一氯乙烷(CH3CH2Cl)的反应类型相同 |
| C.煤油是通过煤干馏获得,可用作燃料和保存少量金属钠 |
D.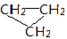 和CH3-CH=CH2互称为同分异构体 和CH3-CH=CH2互称为同分异构体 |
下列关于氧化还原反应的原理分析,正确的是
| A.失电子越多,该物质的还原性就越强 |
| B.含有最高价元素的化合物一定具有强氧化性 |
| C.氧化剂氧化其他物质时,本身被还原 |
| D.某元素由化合态变成游离态一定被还原 |
6g Mg、Cu合金与一定量的硝酸恰好完全反应,收集到标准状况下VL NO和NO2的混合气体。向反应后的溶液中加入足量NaOH溶液,得到沉淀12.12g。则V的值可能是
| A.2.688 | B.4.48 | C.8.064 | D.8.96 |
根据反应:2H2S+O2=2S↓+2H2O,Na2S+I2=2NaI+S↓,4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O,下列物质的氧化性强弱判断正确的是( )
| A.O2>I2>S | B.H2S>NaI>H2O |
| C.S>I2>O2 | D.H2O>NaI>H2S |
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物,这些气体恰好能被500 mL 2.0 mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量是( )
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
已知NaCN溶液呈碱性,(CN)2与卤素单质的性质相似,CN-的还原性介于Br-、I-之间。下列变化不能发生的是( )
A.HCN H++CN- H++CN- |
| B.(CN)2+CH2=CH2―→NC—CH2—CH2—CN |
| C.(CN)2+2Br-=2CN-+Br2 |
| D.(CN)2+2OH-=CN-+CNO-+H2O |
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列说法正确的是( )
| A.白色沉淀是CuI2,棕色溶液含有I2 |
| B.滴加KI溶液时,转移1 mol电子时生成1 mol白色沉淀 |
| C.通入SO2时,SO2与I2反应,I2作还原剂 |
| D.上述实验条件下,物质的氧化性:I2>Cu2+>SO2 |
下列各种转化不符合实质上“一定是被氧化”的是( )
| A.氮的固定 | B.钢铁的腐蚀 | C.食物的腐败 | D.铁或铝在浓硫酸中的钝化 |